
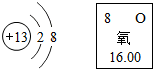 元素化合物知识是初中化学重要的学习内容.请回答下列有关元素化合物的问题.
元素化合物知识是初中化学重要的学习内容.请回答下列有关元素化合物的问题.| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁 | 试管外壁发热 | 原因是氢氧化钠固体溶于水放热 |
| ②向①所得的溶液中逐渐加入稀硝酸至过量 | 一开始无明显现象,一段时间后产生能使澄清石灰水变浑浊的气体 | 样品中含有的杂质是碳酸钠 |
| ③向②所得的溶液中滴加几滴硝酸银溶液 | 产生白色沉淀 | 样品中还含有的杂质是氯化钠 |
分析 (1)根据元素周期表提供的信息和离子结构示意图判断元素的种类,并书写化学方程式.
(2)根据在化学变化中遵循质量守恒定律进行解答.
(3)二氧化碳与氢氧化钠反应生成碳酸钠和水,因此可能有碳酸钠;如果氯化钠没有全部反应的话,溶液中可能含有NaCl.氢氧化钠固体溶于水放热;向①所得的溶液中逐渐加入稀硝酸至过量,反应物中产生能使澄清石灰水浑浊的二氧化碳气体,因此样品中含有的杂质是碳酸钠;向②所得的溶液中滴加几滴硝酸银溶液,产生白色沉淀氯化银,说明样品中还含有的杂质是氯化钠;
(4)根据题意,氢氧化钠溶液与硫酸反应生成硫酸钠和水,用20%的氢氧化钠溶液中和100g硫酸溶液,共消耗氢氧化钠溶液20g,反应后溶液呈中性,结合溶质质量=溶液质量×溶质的质量分数、反应的化学方程式进行分析解答即可.
解答 解:(1)可知图中离子结构示意图可知,质子数为13,代表是离子,甲、乙两种元素的单质间发生反应的化学方程式为:4Al+3O2=2Al2O3;故填:4Al+3O2=2Al2O3;
(2)A、如果硫酸铜溶液显酸性,则锌能和显酸性的溶液反应生成氢气.故A有科学道理;
B、反应物中不含有碳元素,生成物中不可能有二氧化碳.故B没科学道理;
C、因为无色无味气泡产生,可以猜测CuSO4溶液中可能含有少量的某种酸与金属锌反应产生气体,故C有科学道理;
D、如猜测CuSO4溶液中可能含有少量的某种酸,则CuSO4溶液的pH可能小于7,故D有科学道理;
故选B;
(3)【猜想】
二氧化碳与氢氧化钠反应生成碳酸钠和水,因此可能有碳酸钠;氯化钠可能没有全部反应,因此可能有氯化钠;
故答案为:CO2+2NaOH=Na2CO3+H2O;可能有少量的氯化钠没有反应;
【设计实验】
加水溶解,试管外壁发热,原因是氢氧化钠固体溶于水放热;向①所得的溶液中逐渐加入稀硝酸至过量,一开始无明显现象,一段时间后产生能使澄清石灰水浑浊的二氧化碳气体,因此样品中含有的杂质是碳酸钠;向②所得的溶液中滴加几滴硝酸银溶液,产生白色沉淀氯化银,说明样品中还含有氯离子(Cl-),即含有氯化钠;上述实验中稀硝酸不可以用稀盐酸代替,因为盐酸中有氯离子,影响氯化钠中氯离子的检验.
故答案为:氢氧化钠固体溶于水放热;碳酸钠;氯化钠;
(4)设100g废水中的硫酸质量为x
2NaOH+H2SO4═Na2SO4+2H2O
80 98
20g×20% x
$\frac{80}{20g×20%}=\frac{98}{x}$
x=4.9g
所以废水中硫酸的质量分数为:$\frac{4.9g}{100g}$×100%=4.9%.
故答案为:废水中硫酸的质量分数为4.9%
点评 本考点属于实验探究题,既有物质性质的检验,又有化学方程式的书写和有关的计算,综合性比较强.本题根据题目提供的信息,结合实验探究的一般步骤和碱的性质等知识来解决,还要注意化学方程式的书写和配平,有关的计算要准确.本考点主要出现在实验题中.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 编号 | 物质 | 杂质(少量) | 试剂 | 除杂操作方法 |
| A | Fe | Cu | 足量稀盐酸 | 过滤、烘干 |
| B | NaOH | Na2CO3 | 适量的稀盐酸 | 蒸发 |
| C | CO2 | CO | -- | 点燃 |
| D | NaCl | NaOH | 足量稀盐酸 | 蒸发 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 冰雪融化 氮的固定 | B. | 汽油挥发 工业上制取氧气 | ||
| C. | 酒精燃烧 铁生锈 | D. | 水的电解 干冰升华 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com