
过氧化钠(Na2O2)与水发生反应,生成对应的碱和氧气,化学方程式为2Na2O2+2H2O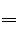
 4NaOH+O2↑。现将78 g过氧化钠放入338 g水中,充分反应。试计算:
4NaOH+O2↑。现将78 g过氧化钠放入338 g水中,充分反应。试计算:
(1)生成的氧气在标准状况下的体积是多少?(已知标准状况下氧气的密度是1.43 g/L)
(2)所得溶液中溶质质量分数是多少?
解:根据反应的化学方程式可知,过氧化钠与水恰好反应时的质量比为156∶36,因此,将78 g过氧化钠放入338 g水中,过氧化钠完全反应,设生成O2和NaOH的质量分别为x和y。则:
2Na2O2+2H2O4NaOH+O2↑
156 160 32
78 g y x
156/32=78 g/x ,解得 x=16 g。
156/160=78 g/y,解得 y=80 g。
(1)故O2在标准状况下的体积为16 g/1.43 g·L-1≈11.2 L。
(2)所得溶液中NaOH的质量分数为80 g/(78 g+338 g-16 g)×100%=20%。
答:(1)生成的氧气在标准状况下的体积是11.2 L;(2)所得溶液中溶质质量分数是20%。


科目:初中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
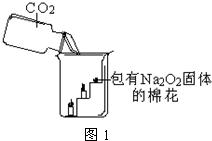
 23、呼吸面具和潜水艇中可用过氧化钠(Na2O2)作为供氧剂.下面是兴趣小组同学围绕过氧化钠进行的一系列探究,请你参与到其中.
23、呼吸面具和潜水艇中可用过氧化钠(Na2O2)作为供氧剂.下面是兴趣小组同学围绕过氧化钠进行的一系列探究,请你参与到其中.
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com