
����Ŀ��ij��ѧ��ȤС�������һϵ��̽���������һͬ���룮
��̽��һ������˿ȼ���Ƿ���Ҫ����
��ʵ�����ݣ���ȡ0.38mm����˿���ֱ����������Ϊ90%��70%��60%��55%��O2��ʵ�飮
��ʵ������
O2% | 90% | 70% | 60% | 55% |
ʵ������ | ȼ�վ��ҡ�ȼ��ʱ�䳤��Ч���� | ȼ�ձ�90%����ȼ��ʱ��̣�ʵ��ɹ� | ȼ�ձ�70%����ȼ��ʱ����̣�ʵ��ɹ� | ����ȼ�գ�ֻ�Ƿ��� |
�����ۣ�����0.38mm��˿���ԣ�ȼ����������������������Ϊ_____��������Ũ��Խ��ȼ������Խ_____��������ҡ������ҡ�����
��̽����������˿ȼ�ղ������������ԭ��
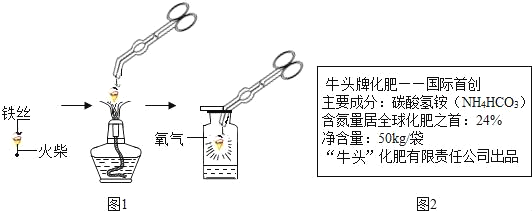
��1����ͼ������״��˿��ĩ��ϵһ������������_____��
��2��С������ͼʵ��ʱ������ƿը���ˣ�����ܵ�ԭ����_____��
��3��С������˿��������ȼ��Ϊʲô������������̽�����±�����������˿�Ͳ�ͬ��̼������˿����˿ֱ��Ϊ0.4mm������������ȼ��ʱ��ʵ������ļ�¼�������������±���
���� | ����˿ | ��̼0.05%����˿ | ��̼0.2%����˿ | ��̼0.6%����˿ |
ȼ��ʱ ������ | ������������ �۶� | ����ȼ�� ���ٻ��� | ����ȼ�� �������� | _____ |
ͨ������ʵ�飬˵����˿ȼ�ղ����������������_____����Ԫ�ط��ţ��йأ�
��̽����������������ij�Ӷ�ˮ��Դ����״��
��1��Ϊ�˱��������ˮ�ʣ����������������ǣ�����ţ�_____��
A ����ˮ�����ж���ֲ������� B �������ŷŹ�ҵ��ˮ
C ��ֹʹ��ũҩ�ͻ��� D ������ˮ�����ŷ�
��2���о��ճ������н�Լ��ˮ��һ�ַ�����_____��
��3��ˮ��Ӳ����һ����Ҫ�Ļ�ѧָ�꣮�ճ��������������Ӳˮ����ˮ��_____��
��4������ʩ�ò���������ˮԴ��Ⱦ��ԭ��֮һ�����DZ���ѧ���ѧʩ�ʵķ�����ij����̼����泥�NH4HCO3�� ���ʵ���ҵ������һ����ͼ��ʾ�Ĵ��ͻ����森
���������Ϣ�ش��������⣺
������ͨ�����㣨д��������̣��жϸù���Ƿ�������ٹ�棺_____
�����������ල���ż�ⷢ�ָû��ʵĺ�����Ϊ17.5%��������NH4HCO3����������Ϊ_____��
���𰸡���55% ���� ����������ȼ��˿ û���ڼ���ƿ�ڷ�������ˮ��ϸɳ ����ȼ�գ��������� C B ������ˮ���� ȡ��֧�Թֱܷ��������Ӳˮ����ˮ��Ȼ�����Թ��зֱ����2��3�η���ˮ����ĭ�������ˮ����ĭ�ٵ���Ӳˮ ����к�����Ϊ24%������̼������еĺ�����17.7%������Ϊ��ٹ�� 98.87%
��������
̽��һ����ͼ����֪��0.38mm��˿���ԣ�ȼ����������������������Ϊ����55%������Ũ��Խ��ȼ������Խ���ң������55%������
̽��������1��ͼ1������״��˿��ĩ��ϵһ����������������������ȼ��˿���������������ȼ��˿��
��2����ͼ1ʵ��ʱ������ƿը���ˣ�����ܵ�ԭ����û���ڼ���ƿ�ڷ�������ˮ��ϸɳ��ȼ�����ɵĸ��¹�������ը�Ѽ���ƿ�����û���ڼ���ƿ�ڷ�������ˮ��ϸɳ
��3����ͼ����֪����˿ȼ�ղ����������������̼Ԫ�غ����й��Ҷ�0.2mm����˿���ԣ���̼��Խ�ߣ�������������Խ���ԣ��������ȼ�գ��������䣻C
̽��������1������ˮ�����ж���ֲ�����������ֹʹ��ũҩ�ͻ��ʣ���Ȼ�ɱ���ˮ�ʵ�ȴ�Dz�����ʵʩ�ľٴ룬�ʲ�������������ˮ�����ŷŻ���Ⱦˮ��Դ���������������������ŷŹ�ҵ��ˮ���ǿ��еı���ˮ�ʵĺ������������B
��2����Լ��ˮ�����������࣬��һˮ���ã�������ˮ��������ϴ�·���ˮ������ȣ�����ˮ��ʱ�ر�ˮ��ͷ��ʹ�ý�ˮ��ͷ����ҵ����ˮ����������ѭ��ʹ�á�ũҵ�ϸı��ȵķ�ʽ�������м�ǿ��Լ��ˮ����ʶ�����������ˮ����
��3������Ӳˮ����ˮ����Ҫ�������÷���ˮ������ĭ�������ˮ����ĭ�ٵ���Ӳˮ�����ȡ��֧�Թֱܷ��������Ӳˮ����ˮ��Ȼ�����Թ��зֱ����2��3�η���ˮ����ĭ�������ˮ����ĭ�ٵ���Ӳˮ
��4����̼������е�Ԫ�ص���������Ϊ��![]() ��100%��17.7%������к�����Ϊ24%������̼������еĺ�����17.7%������Ϊ��ٹ�棻�������к�����Ϊ24%������̼������еĺ�����17.7%������Ϊ��ٹ��
��100%��17.7%������к�����Ϊ24%������̼������еĺ�����17.7%������Ϊ��ٹ�棻�������к�����Ϊ24%������̼������еĺ�����17.7%������Ϊ��ٹ��
��NH4HCO3������������![]() ��100%��98.87%�����98.87%
��100%��98.87%�����98.87%



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��A��B��C�������ʵ��ܽ�����ߣ�������������ش�
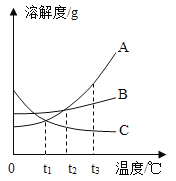
(1)t3��ʱ��A��B��C�������ʵ��ܽ����С�����˳��Ϊ _________��
(2)t2��ʱ��A��B��C�������ʵı�����Һ���µ�t l��ʱ��Ϊ��������Һ����________��
(3)��A�к���������B���ɲ���____________(��������������������)�ᾧ�ķ����ᴿA���ʡ�
(4)t3��ʱ������A��B�����ʸ�50g��ɱ�����Һ���������ˮ������A_______B(������������������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƣ�Na2O2����һ�ֵ���ɫ�Ĺ��壬������CO2��H2O��Ӧ���仯ѧ����ʽΪ��2Na2O2+2CO2�T2Na2CO3+O2��2Na2O2+2H2O�T4NaOH+O2����Ϊ̽��ʵ���ҳ��ڷ��õĹ��������й���ijɷ֣���С��ͬѧ����������ʵ�飬��ش���������
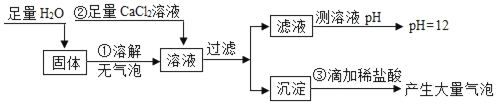
��1���ɲ������е�ʵ������ɵó�ʲô���ۣ�
��2���������������Լ���Ŀ����ʲô��
��3������ʵ���жϳ��ڷ��õĹ��������й���ijɷ���ʲô��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���ܵ�ʵ��Ŀ����
A.  ̽������ʴ���� B.
̽������ʴ���� B.  ̽��ȼ������
̽��ȼ������
C.  �ⶨ�������������� D.
�ⶨ�������������� D.  ̽�������˶�
̽�������˶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�鷽�������ܴﵽ��Ӧʵ��Ŀ���ǣ�������
A. 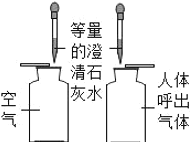 �ȽϿ��������������������CO2����
�ȽϿ��������������������CO2����
B. 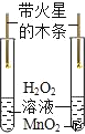 ̽��MnO2�ܷ�ӿ�H2O2�ֽ�
̽��MnO2�ܷ�ӿ�H2O2�ֽ�
C. 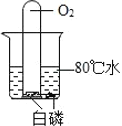 ��֤ȼ����Ҫ�¶ȴﵽ�Ż��
��֤ȼ����Ҫ�¶ȴﵽ�Ż��
D. 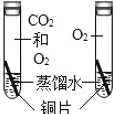 ̽��CO2��ͭ�����Ƿ���Ӱ��
̽��CO2��ͭ�����Ƿ���Ӱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС��������ͼ��ʾװ��(ͼ�й̶�װ������ȥ)�ⶨͭп�Ͻ���п������������̽���������£�
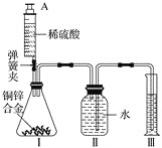
������ʵ��װ�ò����װ�������ԡ�
����װ�â��е���ƿ����2.0g��ͭп�Ͻ���Ʒ��ĩ����ע��������ע��ϡ���ᣬ������ƿ�в��ٲ�������ʱ��ȷ��ȡע�����ڶ���������10.5mLϡ���ᣬͬʱ�����н����ɼУ��Ƴ�װ�â��еĵ��ܣ�ȷ��ȡ��Ͳ��ˮ�����Ϊ214.0mL(ע����Ʒ�е����ʲ��μӷ�Ӧ
��װ�â���ʣ��������ʾ����ʵ�������ȷ����������Ϊ1.4g
�ܸ�С�����λͬѧ����ʵ����̲�ò�ͬ���ݣ�����ͭп�Ͻ���Ʒ��п����������
��ͬѧ����װ�â��з�Ӧǰ�������������м��㣻
��ͬѧ����װ�â��м���ϡ����������м��㣻
��ͬѧ����װ�â�����ȡˮ��������м��㣬����ã��ڱ�״���£��������ܶ�Ϊ0.09gL��1��
�ش��������⣺
(1)װ�â��з�Ӧ�Ļ�ѧ����ʽΪ___��ʵ������������ϡ���������ٲ������壬Ŀ����___��
(2)������г���ʣ�����֮ǰ����ȷ������_______��ϴ�ӡ����
(3)����ʵ��ⶨ�����ݣ�������λͬѧ��________(������������������������)ͬѧ�����м�����Ʒ��п������������
(4)��ѧС��ͬѧ���֣����ձ�ͬѧ�ķ������м��㣬��ʹʵ�������ֽϴ�ƫ��������ؿ������ƫ�����________(����)��
A �Ƴ�װ�â�ʱ��������������һ����ˮ
B ʵ�����ǰ��û���ų�װ�â��еĿ���
C ���ݴ���ʱ��δ�ų�����ϡ������ռ�����
���𰸡���1��![]() ��ʹ��Ʒ�е�п��ȫ��Ӧ����2�����ˣ���3���ң���4��AC��
��ʹ��Ʒ�е�п��ȫ��Ӧ����2�����ˣ���3���ң���4��AC��
��������
���⣨1������ͭ��������ĺ��棬���������Ӧ����Ӧ����п�����ᣬ������������п��������������������������ţ�ʵ������������ϡ���������ٲ������壬Ŀ����ʹ��Ʒ�е�п��ȫ��Ӧ����2����ͭ������п��Һ�Ļ�����еõ�ͭ���Ƚ��й��ˣ��õ���������п��Һ��ͭ���ٽ���ϴ�ӳ�ȥ���������п���ٽ��и����ȥˮ���ɣ���3�����ݼ���ϡ����������м�����Ҫ֪��ϡ�������������������������û�и�֪����4������п�����ᷴӦ��������п������ʱ���ų����������û����ȴ�����£���������������ԭ����֪������Ͳ��ˮƫ�࣬��������Ϊ�õ��������࣬�پ������ݴ���ʱ��δ�ų�����ϡ������ռ�����������Ľ����ƫ��
���㣺�����Ļ�ѧ���ʣ���ѧ����ʽ��ʵ����������
��������ǽ������˳�����֪��������֮ǰ�Ľ�����ϡ����������ᷴӦ������������������֮��Ľ�����ϡ�������ϡ���������������ѧ��Ӧ�����ʵ������ȶ��Ǵ�����֮��������ȣ�����Һ�����ʵ�����=��Һ���������������������������׳����ĵط��Ƕ�ʵ���������ۣ�Ҫ֪��п�����ᷴӦ�ų��������������Ӧ����������ȴ�����²��ܽ��й۲�ͼ��㡣
�����͡�ʵ����
��������
30
����Ŀ����1000t��������80���ij�����ʯ�������Ͽ�����������96���������������Ƕ��٣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʳ���г�������CaCl2��MgCl2��Na2SO4���ô����Ʊ�����ʱ��ͨ�������ܽ⡢���ӡ����˺������IJ�����������������Һ�м���NaOH��Һ��Na2CO3��Һ��BaCl2��Һ������(�����Թ���)��Ŀ�ľ��dz��ӡ�������Һ��˳��������
A. BaCl2��Һ��NaOH��Һ��Na2CO3��Һ������
B. NaOH��Һ��BaCl2��Һ��Na2CO3��Һ������
C. Na2CO3��Һ��BaCl2��Һ��NaOH��Һ������
D. BaCl2��Һ��Na2CO3��Һ��NaOH��Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ֧�Թ��з���һС��þ��(�Ѳ�ȥ����Ĥ)�������Թ��м���һ���������ᣬþ��������_____��������Ӧ�Ļ�ѧ����ʽ��_____��
[��������]Ϊ���ٴι۲�������Ӧ����С��ͬѧ�ýϳ���þ����������ʵ�飬���������쳣�����Թ��г����˰�ɫ������
[ʵ����֤1]С��ͬѧ�������ʵ��IJ�ͬ����ƶԱ�ʵ�鷽����̽�������쳣�����ԭ��
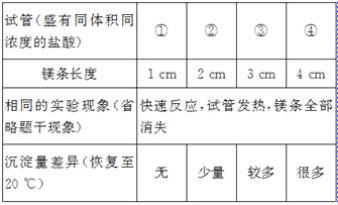
[�ó�����]þ�������ᷴӦ������ɫ������_____�йء�
[��]��ɫ������ʲô���ʣ�
[��������]��20 ��ʱ��100 gˮ��������ܽ��Ȼ�þ54.8 g��
��þ������ˮ��Ӧ����һ�ּ��������
���Ȼ����Ȳ�����ˮҲ������ϡ���ᡣ
[��������]����һ��þ����������Ȼ�þ����������������þ�������������_____(�û�ѧ����ʽ��ʾ)��
[ʵ����֤2]����ɫ����ϴ�Ӹɾ����ֱ�ȡ����������A��B��C�Թ��У��������ʵ�飺
�Թ� | ���� | ���� | ���� |
A | ������������ | _____����ɫ����_____ | ����һ����ȷ�������ְ�ɫ�������������� |
B | ��������ˮ | ��ɫ����_____ | ���������ȷ |
C | ��������ϡ���� | ��ɫ������ʧ | ԭ��ɫ�����к��е������ǣ�Mg2+��_____ |
�����μӼ�����������Һ | ���ִ�����ɫ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ֹ������ʴ���ر��Ǹ�������ʴ�������ѧ���о��ͼ��������е��ش����⡣
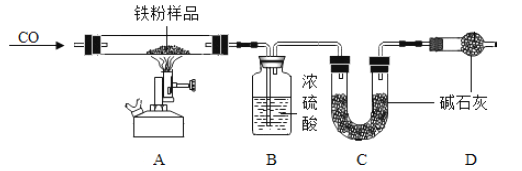
��1�������������Ϊ��_____ͬʱ���������ɷָ��ӣ���Ҫ�ɷ�Ϊ��������Fe2O3��_____���ʿɼ���������ʴ���������ȥ����Ļ�ѧ����ʽΪ_____��Ϊ�˷�ֹ����Ʒ���⣬Ӧ��ȡ�Ĵ�ʩ��_____��д��һ�֣���
��2�����������ϣ�С��ͬѧ��������������������е����ʷ�����һϵ�и��ӵĻ�ѧ��Ӧ������������������Fe��OH��2���������ڿ����б�����Ϊ����������Fe��OH��3����Fe��OH��3���ȶ��������������·��������ķֽⷴӦ������������Fe2O3��������Ļ�ѧʽ�ɼ�ʾΪFe2O3nH2O��
��������⣩���⣨Fe2O3nH2O���е�n��ֵ���ڶ����أ�
������̽����С������ʵ��������һ���ܲ��Ƶ����ۣ����Ѿ����ɺ��ɫ��Ϊ��̽�����⣨Fe2O3nH2O������ɣ���ȡ27.0g����������Ʒ������ͼ��ʾװ�ý���ʵ�顣
��Ϊ�˱�֤ʵ�鰲ȫ��ʵ�鿪ʼʱӦ��_____����ֹ_____��
��A�е�������_____��B��Ũ�����������_____��D�м�ʯ�ҵ�������_____
����ָ����װ������һ�����Բ���_____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com