
【题目】武汉将成为我国首个新型氢能城市。某化学兴趣小组在老师的帮助下围绕氢气的燃烧实验开展如下探究:
(1)点燃氢气前,一定先要________。点燃纯净的氢气可以看到淡蓝色火焰现象,该反应的化学方程式为________,该反应的基本类型为______反应。
(2)研究氢气燃烧实验,需要用试管收集不同体积比的氢气与空气的混合物,若用试管(假设试管容积为10mL)收集氢气与空气体积比为4:1的混合气体,其操作方法为________。
(3)用不同体积比的混合气体做氢气的燃烧实验,结果如表:
序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
氢气与空气体积比 | 9:1 | 8:2 | 7:3 | 5:5 | 3:7 | 1:9 | 0.5:9.5 |
点燃现象 | 安静 燃烧 | 安静 燃烧 | 弱的 爆鸣声 | 强的 爆鸣声 | 强的 爆鸣声 | 弱的 爆鸣声 | 不燃烧 不爆鸣 |
请分析上表信息,你对燃烧或燃烧条件的新认识是可燃物能否燃烧除具备燃烧条件,还要考虑到________。
【答案】检验纯度  化合 试管先装入8mL水,用拇指堵住试管口,倒扣在水槽中,用排水法收集氢气,将剩余的水排出 与可燃物的浓度(或纯度)有关(或其他合理答案)
化合 试管先装入8mL水,用拇指堵住试管口,倒扣在水槽中,用排水法收集氢气,将剩余的水排出 与可燃物的浓度(或纯度)有关(或其他合理答案)
【解析】
(1)氢气具有可燃性,点燃不纯的氢气可能会发生爆炸,所以点燃氢气前,一定先要检验纯度。纯净的氢气能安静的燃烧,产生淡蓝色火焰,产物是水,反应的化学方程式为 ,该反应是两种物质生成一种物质,属于化合反应。
,该反应是两种物质生成一种物质,属于化合反应。
(2)用容积为10mL试管收集氢气与空气体积比为4:1的混合气体,则氢气为8mL,空气为2mL。操作方法是试管先装入8mL水,用拇指堵住试管口,倒扣在水槽中,用排水法收集氢气,将剩余的水排出。
(3)从表中数据分析可知,可燃物能否燃烧除具备燃烧条件,还要考虑到反应物的浓度。


科目:初中化学 来源: 题型:
【题目】现有含杂质的硝酸钠溶液,为确定其组成,某同学设计了如下实验。下列判断正确的( )
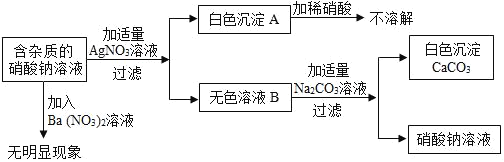
A. 无色溶液B的溶质只有硝酸钙
B. 该实验中涉及的基本反应类型不止一种
C. 生成白色沉淀A的反应是化合反应
D. 原溶液中的杂质可能由氯化钙、硝酸钙、氯化钠组成
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】黄铁矿(主要成分为二硫化亚铁,FeS2)可用于工业制备硫酸(H2SO4),其所得矿渣中氧化铁(Fe2O3)含量较高,可用于高炉炼铁。其工业流程图如图所示:
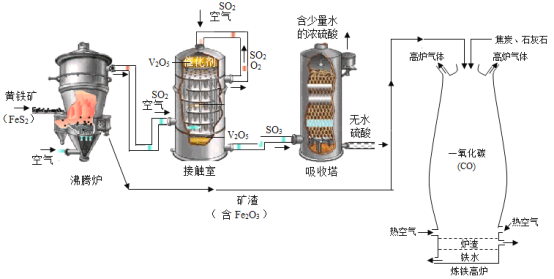
其中高炉炼铁的另两种原料分别为焦炭和石灰石(主要成分为CaCO3),其基本原理为:焦炭在高温下先转化为一氧化碳(CO),一氧化碳再与氧化铁(Fe2O3)在高温下反应制得铁。石灰石的作用是将杂质转化成炉渣除去。请回答下列问题:
(1)请将沸腾炉里的反应填写完整:4FeS2+11O2![]() 2Fe2O3+______。
2Fe2O3+______。
(2)黄铁矿粉碎的目的是______。
(3)将从接触室中排出来的SO2和空气重新送回接触室的目的是______。
(4)试写出炼铁高炉中一氧化碳炼铁的化学方程式______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以下为制备纳米CaCO3的一种流程:

(1)实验室中进行操作1、2时,所用玻璃仪器有______、玻璃棒和烧杯。
(2)该流程中可以循环使用的物质是______。
(3)操作2中产生的氯化铵在农业上可用作______。
(4)操作2所得固体用蒸馏水洗涤。检验固体已洗净的方法是______。
(5)实验时将250克含碳酸钙为80%的矿石用盐酸溶解,至少需要7.3%的稀盐酸______克.(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据如图所示装置回答有关问题:
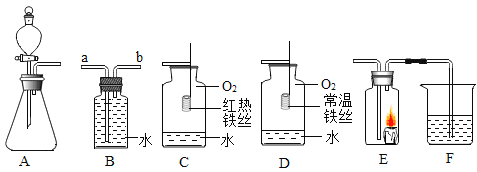
(1)若用装置B排水收集氧气,气体应从_______(填“a”或“b”)导管通入瓶内: 瓶底留少量水进行装置C中的实验,水的作用是______。
(2)对比装置C和D,可以得出关于可燃物燃烧的条件是_______。
(3)甲、乙两同学分别连接A、E、F进行实验,A中所加药品不同,F中所加药品相同。
①甲在实验时E中蜡烛熄灭,F中溶液变浑浊,则A中反应的化学方程式为_______。E中蜡烛熄灭,说明A中产生的气体所具有的性质为______。
②乙在实验时E中蜡烛燃烧更旺,F中溶液变浑浊,则A中反应的化学方程式为______。
③F中溶液变浑浊的化学方程式为______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】第七届世界军人运动会“和平荣光”火炬采用环保型燃料丙烷。丙烷分子结构模型如下图所示,下列有关丙烷的叙述中不正确是( )
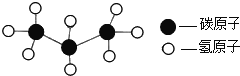
A.丙烷属于有机化合物B.丙烷由碳、氢两种元素组成
C.丙烷由丙烷分子构成D.丙烷中碳、氢两种元素的质量比3:8
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学研究小组在开展了“过氧化氢制取氧气的反应中二氧化锰的作用”之后,又进行了“寻找新的催化剂”的探究实验。
(提出问题 1)寻找“氧化铁能否用于过氧化氢溶液分解的催化剂”的证据?如果能, 它的催化效果如何?
(实验设计 1)
实 验 | 现 象 |
Ⅰ.分别量取 5 毫升 5%的过氧化氢溶液于 A、B 两支试管中,向 A 中加入 a 克氧化铁粉末,并分别在 A、B 两支试管中伸入带火星的木条,观察现象。 | A 试管中产生气泡,带火星的木条复燃,B 试管中无明显现象 |
Ⅱ.将“实验Ⅰ”中 A 试管的剩余物质分离,将所得固体进行洗涤、干燥、称量 | 所得固体质量为 a 克 |
Ⅲ.将“实验Ⅱ”得到的固体放入盛有 5 毫升 5%的过氧化氢溶液的试管中,向试管中伸入带火星的木条 | 有气泡冒出,带火星的木条复燃 |
Ⅳ.分别量取 5 毫升 5%的过氧化氢溶液放入 C、D 两 支试管中,向 C 试管中加入 a 克氧化铁粉末,向 D 试管中加入 a 克二氧化锰粉末 |
(实验结论)
(1)A 中产生的气体是_____;
(2)氧化铁可以作过氧化氢分解的催化剂,寻找该结论的证据主要是设计了实验_____(选填Ⅰ、Ⅱ、Ⅲ或Ⅳ)展开的。
(实验评价)
(1)设计实验Ⅲ的目的是_____;
(2)可以用下列方法作出判断,从而达到实验Ⅳ的设计目的。a.定性判断:观察 C、D两支试管中产生气泡的快慢;b.定量判断:_____。
(资料信息)过氧化氢分解除了用二氧化锰还可用氧化铜等物质作为催化剂
(提出问题 2)氧化铜(黑色粉末)是否也能作氯酸钾分解的催化剂?它是否比二氧化锰效果更好?
(实验设计 2)某同学以生成等体积的氧气为标准,设计了下列三组实验(其它可能影响实验的因素均忽略)。
实验序号 | 氯酸钾质量 | 其他物质质量 | 待测数据 |
① | 1.2 克 | X | |
② | 1.2 克 | 氧化铜 0.5 克 | Y |
③ | m | 二氧化锰 0.5 克 | Z |
(1)写出氯酸钾在二氧化锰的催化作用下发生的反应的化学方程式:_____。
(2)上述实验应测量的“待测数据”是指_____,从数学描述角度,X、Y、Z 在数值上的大小关系是_____。
(3)若实验②比实验①的“待测数据”更_____(填“大”“小”或“不确定”),说明氧化铜能加快氯酸钾的分解速率。表中“m”的数值应该为_____。
(4)将实验②反应后的固体经过过滤、洗涤、干燥处理后,称量得到 0.5 克黑色粉末, 再将黑色粉末放入_____(简述操作)。
(总结提高)二氧化碳可用于灭火,但不是所有可燃物失火都可以用二氧化碳来扑灭。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】三位美国科学家通过计算机模拟酶催化反应机理,发表了全球第一个酶类反应的计算机模型,终于实现了对所有分子的普遍适用性。则回答:
(1)他们在分子尺度(层次)上成功模拟研究蛋白质分子,计算出生命化学的通用程序。下列有关蛋白质的说法中不正确的是(_______)
A蛋白质是由碳、氢、氧三种元素组成的有机化合物
B若少量的重金属盐中毒,可以食用含蛋白质的食物来解毒
C青少年多喝富含蛋白质的牛奶,有利于健康
D甲醛能与蛋白质发生反应,失去原有的生理活性
(2)酶也是一类重要的蛋白质,是生物催化剂。下列图像为计算机模拟人体内某种酶在不同pH条件下,酶催化效率与温度之间的相互关系。请从图像中进行

①人体体温t1为37℃时,各种酶催化效率最___(填“高”或“低”);
②在温度从0→t2的变化中,酶的催化效率变化规律应是_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下列科普文章。
我国是世界上少数几个以煤(主要含碳、氢、氧、氮、硫等元素)为主要能源的国家。相对单一的能源消费模式,导致了能源供需结构的失衡,同时带来了严重的环境影响。2016年,我国石油产量为1.997亿吨,消费量却达到5.787亿吨。因此,把煤制成油,一直是我国调整能源结构的重要战略决策。
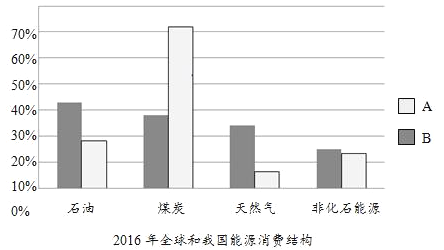
煤制油被称为煤的液化。一种工艺是先将煤送入汽化炉内,转化成粗煤气,再进一步处理后得到仅含CO和H2的合成气,然后以合成气为原料,在一定的温度、压强和催化剂条件下合成甲醇(CH3OH),再利用甲醇合成燃料油。
我国在煤制油工业生产上的优势之一是用非常廉价的原材料做成催化剂,这一技术为我国能源结构的可持续发展做出了重要贡献。
依据文章内容,回答下列问题。
(1)我国以煤炭为主的能源消费模式的弊端是_____。
(2)在2016年能源消费结构图中,能代表我国能源消费结构的是_____(填“A”或“B”)
(3)甲醇(CH3OH)中碳、氢元素的质量比为_____。
(4)将煤转化成煤气的反应为![]() ,该反应中涉及的物质属于氧化物的是_____。
,该反应中涉及的物质属于氧化物的是_____。
(5)下列说法正确的是_____。
A 我国的能源消费主要是化石燃料
B 我国在2016年的石油消费量远大于产量
C “煤制油”技术有助于解决煤多油少的结构性缺点
D “煤制油”的过程只发生物理变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com