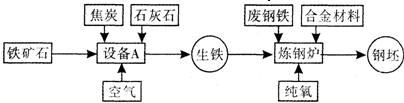
解::(1)工业上由铁矿炼铁的设备是高炉;
(2)炼铁的原理是利用还原剂CO把金属氧化物还原为金属单质,自身生成CO
2的过程,反应的化学方程式为:4CO+Fe
3O
4
3Fe+4CO
2;
(3)由于碳和氧气反应放热,所以应该是下部温度最高.
(4)物质发生反应,实际上是物质微粒的相互碰撞,微粒浓度越大反应越充分、越剧烈,故炼钢中选用氧气而不选空气是为了促使反应更加剧烈,并获得更多的热量,维持其他反应进行;
(5)设生成二氧化碳的质量为x.
CO
2+Ca(OH)
2=CaCO
3↓+H
20
44 100
x 0.25g
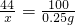
x=0.11g
0.11g二氧化碳中碳元素的质量=0.11g×

=0.03g
钢样中含碳质量分数=
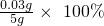
=0.6%
答:钢样中含碳质量分数为0.6%.
故答案为:(1)高炉;(2)4CO+Fe
3O
4
3Fe+4CO
2;(3)下部;(4)放热、使反应快速进行,放出更多的热,维持其他反应进行;(6)0.6%.
分析:(1)根据工业上由铁矿炼铁的设备是高炉进行解答;
(2)炼铁的原理是利用还原剂CO在高温下还原Fe
3O
4;
(3)反应在下部进行,所以下部温度最高.
(4)炼钢时的反应为放热反应,所以不需另用燃料加热;产物中因含有少量杂质而变成生铁,炼钢是进一步除去炼出的铁中的杂质的过程,利用的是氧气与杂质金属反应.因为杂质含量本来就不多,所以如果采用空气的话,氧气含量只有不到1/5,与杂质金属接触的几率更小了,不利于除杂,氧气浓度越大碰撞几率越大也更容易除去杂质;
(5)根据沉淀的量进行计算即可.
点评:本题主要考查炼铁的设备及原理,其中有考查了还原反应的书写与配平;从微观的角度考查化学反应的实质;利用化学方程式进行计算.此类题综合性较强,相关联的知识点较多,是中考的一个难点和重点.


 3Fe+4CO2;
3Fe+4CO2;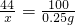
 =0.03g
=0.03g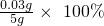 =0.6%
=0.6% 3Fe+4CO2;(3)下部;(4)放热、使反应快速进行,放出更多的热,维持其他反应进行;(6)0.6%.
3Fe+4CO2;(3)下部;(4)放热、使反应快速进行,放出更多的热,维持其他反应进行;(6)0.6%.

 导学全程练创优训练系列答案
导学全程练创优训练系列答案