
【题目】工业上生产电石(CaC2)制备重要工业原料乙炔(CxHy)流程如下:
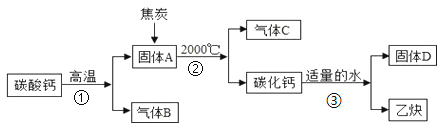
请回答下列问题:
(1)写出碳酸钙高温分解①的化学方程式____________________;B、C组成的元素相同,C有毒,则反应②的化学方程式____________________;根据反应③可推断固体D中一定含有的元素是____________________。
(2)已知:浓硫酸具有强吸水性。一个乙炔分子由4个原子构成。为了测定乙炔的组成,将一定量的乙炔(CxHy)完全燃烧,并将生成的气体缓缓通过下图的__________(选填“甲”或“乙”)装置,再缓缓通过一段时间的N2,缓缓通过一段时间的N2的目的是__________。
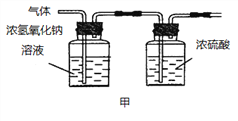
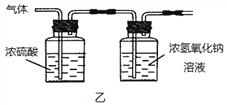
记录实验数据如下:
装置 | 反应前质量 | 反应后质量 |
浓硫酸 | 125.3g | 127.1g |
浓氢氧化钠溶液 | 78.2g | 87.0g |
根据实验数据推断乙炔的化学式(写出推断过程):__________
【答案】 CaCO3![]() CaO+CO2↑ CaO+3C
CaO+CO2↑ CaO+3C![]() CaC2+CO↑ 乙 使生成的气体完全被吸收 乙炔中氢元素的质量:(127.1g-125.3g)×
CaC2+CO↑ 乙 使生成的气体完全被吸收 乙炔中氢元素的质量:(127.1g-125.3g)×![]() =0.2g,乙炔中碳元素的质量:(87.0g-78.2g)×
=0.2g,乙炔中碳元素的质量:(87.0g-78.2g)×![]() =2.4g,根据题意有:
=2.4g,根据题意有:![]() =
=![]() ,解得
,解得![]() =
=![]() C2H2
C2H2
【解析】 (1)碳酸钙高温分解的化学方程式为:CaCO3![]() CaO+CO2↑,B、C组成的元素相同,C有毒,则C是CO,B是CO2。化学反应前后元素种类不变,各种原子个数相等,故反应的化学方程式为:CaO+3C
CaO+CO2↑,B、C组成的元素相同,C有毒,则C是CO,B是CO2。化学反应前后元素种类不变,各种原子个数相等,故反应的化学方程式为:CaO+3C![]() CaC2+CO↑,根据化学反应前后元素种类不变,可推断固体D中一定含有的元素是钙元素和氧元素。(2)将一定量的乙炔完全燃烧,生成的气体全部缓缓通过乙装置,这样可以避免气体通过氢氧化钠溶液时带出的水蒸气,故选乙。再缓缓通过一段时间的N2,目的是使生成的气体完全被吸收。浓硫酸增加的质量是生成水的质量,所以生成水的质量为:127.1g-125.3g=1.8g,浓氢氧化钠溶液增加的质量是生成二氧化碳的质量,所以生成二氧化碳的质量为:87.0g-78.2g=8.8g。1.8g水中氢元素的质量为:1.8g×
CaC2+CO↑,根据化学反应前后元素种类不变,可推断固体D中一定含有的元素是钙元素和氧元素。(2)将一定量的乙炔完全燃烧,生成的气体全部缓缓通过乙装置,这样可以避免气体通过氢氧化钠溶液时带出的水蒸气,故选乙。再缓缓通过一段时间的N2,目的是使生成的气体完全被吸收。浓硫酸增加的质量是生成水的质量,所以生成水的质量为:127.1g-125.3g=1.8g,浓氢氧化钠溶液增加的质量是生成二氧化碳的质量,所以生成二氧化碳的质量为:87.0g-78.2g=8.8g。1.8g水中氢元素的质量为:1.8g×![]() =0.2g,8.8g二氧化碳中碳元素的质量为:8.8g×
=0.2g,8.8g二氧化碳中碳元素的质量为:8.8g×![]() =2.4g,根据题意有:
=2.4g,根据题意有:![]() =
=![]() ,解得
,解得![]() =
=![]() , 因为一个乙炔分子由4个原子构成,所以乙炔的化学式是C2H2
, 因为一个乙炔分子由4个原子构成,所以乙炔的化学式是C2H2


科目:初中化学 来源: 题型:
【题目】水之问。
(1)通过如图电解水实验,证明水是由_____元素组成,当其中一个电极产生5 mL气体时,另一电极产生的气体体积可能是_____ mL。

(2)宁德山川秀美,小林秋游带回一瓶山泉水,取样加入适量肥皂水,振荡产生较多泡沫,则该山泉水属于_____(填“硬水”或“软水”)。
(3)自来水在传输过程中若存在细菌,在家中饮用该水之前,用_____方法处理。
(4) “海波”是常见的基本药物,为无色透明晶体,熔点为48℃,沸点100℃,用图装置对“海波”进行熔化,其中水的主要作用是_____ (填序号,可多选)。

A.此实验中水起到控制温度的作用
B.水能迅速加快“海波”的熔化
C.使“海波”受热更均匀
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲和乙可以合成清洁燃料丙,微观过程如图。下列说法错误的是
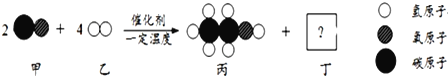
A. 丁的化学式为H2O B. 丙中C、H、O的质量比为12:3:8
C. 该反应中有三种氧化物 D. 参加反应的甲和乙的质量比是7:1
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】一化工厂产生的废液中含有硫酸亚铁和硫酸铜(不考虑其他物质),为回收铜和硫酸亚铁,研究人员设计出“用铁处理”的方案。取100 g上述废液,向其中加入2.8 g铁粉,恰好完全反应,测得反应后溶液中溶质的质量分数为15%。求:
(1)回收得到铜的质量为________g。
(2)回收得到硫酸亚铁的质量是__________g?(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在宏观、微观和符号之间建立联系是化学学科的特点。
(1)在符号①Fe3+ ②H2O2 ③SO42- 中,表示阳离子的是__________;①和③形成化合物的化学式是_________。
(2)某密闭容器中物质变化过程的微观示意图如下:
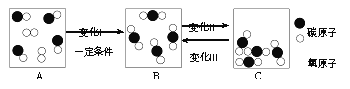
①A、B、C中表示混合物的是_____(填序号)。
②上述变化Ⅰ、Ⅱ和Ⅲ中,属于物理变化的是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在“宏观一微观”之间建立联系,是学习化学学科必备的思维方式。下图是某反应的微观示意图,下列说法正确的是
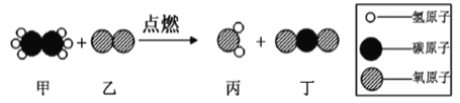
A. 该反应中甲、乙、丙、丁都属于化合物 B. 反应生成丙、丁分子个数比为1:1
C. 参加反应的甲、乙的质量比为60: 224 D. 该反应属于置换反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】矿山废水中含有大量的H2SO4和CuSO4,直接排放会影响水体酸碱性,并造成重金属污染。通过处理可以回收金属铜,并使废水pH和重金属含量达到排放标准。

已知:步骤I无蓝色沉淀生成。
(1)步骤Ⅱ和步骤Ⅲ都需进行的操作是_______。
(2)步骤Ⅱ得到金属铜的反应的化学方程式为_______。
(3)加入Ca(OH)2可以降低铁屑的消耗量,原因是_______(请用文字并结合化学方程式解释)。
(4)步骤Ⅲ需加入Na2S才能使废水达到排放标准,由此推测废水③不达标的主要原因 是其中含有_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组用下图所示装置研究两个问题(夹持装置已略去)。
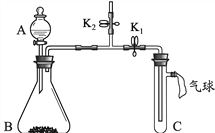
(1)研究燃烧的条件
【步骤1】向C中加入少量白磷,再加入热水,塞好胶塞,使导管口浸入热水中,白磷不燃烧。
【步骤2】打开K1,关闭K2,将A中溶液滴入B中,C中有气泡冒出,白磷燃烧。B中发生反应的化学方程式为__________________。此实验运用对比的方法研究了燃烧的一个条件,它是_______________________。
(2)研究二氧化碳与氢氧化钠的反应
A中盛有稀硫酸,B中盛有碳酸钠固体,C中盛有氢氧化钠固体。
【实验1】打开K1,关闭K2,将A中溶液滴入B中,气球明显鼓起。打开K2,关闭K1,一段时间后,气球没有明显变瘪。
实验1没有出现预期的实验现象,改进后重新加入药品进行了实验2。
【实验2】打开K2,关闭K1,将A中溶液滴入B中,用燃着的木条放在K2上方的导管口处,木条熄灭。上述实验操作的目的是____________________。然后进行后续实验,证明二氧化碳与氢氧化钠发生了反应,后续实验的操作及现象是_____________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下列实验装置图,回答相关问题。
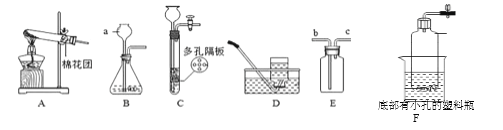
(1)图中标有 a 的仪器名称是_________________。
(2)用高锰酸钾制取较纯净的氧气,装置组合是_______________(填字母),化学方程式为_______________。 试管口放一团棉花的作用是______________________。
(3)实验室制取二氧化碳的化学方程式为___________,选择 E 装置收集二氧化碳,气体应从_________(填“b”或“c”)端通入,检验生成的气体是二氧化碳的方法是_______。 小明组装了 F 装置用于制取二氧化碳,该装置能达到的效果相当于图中的_____________填字母)装置,F 装置中的石灰石可用________________(填字母)替代。
A.大理石 B.洗净的鸡蛋壳 C.苏打粉
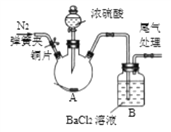
(4)查阅资料获知:二氧化硫与氯化钡溶液不反应。小明设 计了右图装置(加热和夹持装置已略)进行验证,操作步骤如下:①检查装置气密性;②装入铜片;③关闭弹簧夹;④滴入浓硫酸,加热;⑤打开弹簧夹,通入氮气。
Ⅰ.装置 A 中铜与浓硫酸加热生成硫酸铜、二氧化硫和水,反应的化学方程式为______ 。
Ⅱ.实验过程中,小明意外发现装置 B 中出现白色沉淀,经检验白色沉淀为硫酸钡, 小明认为可能是空气中的氧气参与反应导致。为检验该观点是否正确,小明在原实验基础 上增加了一步操作,并重新完成该实验,装置 B 中果然无沉淀产生。该操作是_________, 该操作应排在操作______________(填序号)之后。实验结果表明:二氧化硫通入氯化钡溶液理 论上不产生沉淀,而实际因氧气的影响往往能观察到沉淀现象。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com