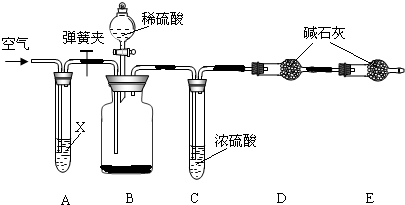
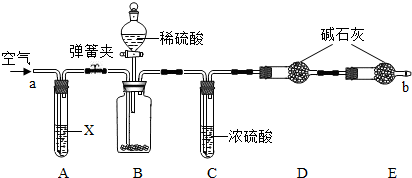
解:(1)从该题的后半部分可以看出在检验气密性时是把ab两个管口堵上然后向分液漏斗中添加水的方法来检验的
(2)由题意可知我们是通过测定二氧化碳的质量来测定碳酸钠的质量分数的,所以要排除空气中的二氧化碳干扰实验结果,故应在A中装碱的溶液来吸收空气中的二氧化碳
(3)浓硫酸具有吸水性,在C装置中吸收由B装置排出气体中混有的水蒸气,若少了此装置则会使气体中的水蒸气被D装置中碱石灰吸收,而使测定质量偏大;
(4)反应中放出二氧化碳气体的质量=85.6g-83.4g=2.2g
设放出2.2g二氧化碳消耗碳酸钠的质量为x
Na
2CO
3+H
2SO
4═Na
2SO
4+H
2O+CO
2↑
106 44
x 2.2g
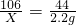
,解得x=5.3g
纯碱样品Na
2CO
3的质量分数=
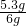
×100%=88.3%
故答案为:
(1)将a、b两端堵住,打开分液漏斗,向分液漏斗中加水
(2)使反应生成的二氧化碳气体被D中碱石灰完全吸收
氢氧化钠溶液
(3)偏大
(4)88.3%
分析:(1)根据该题的后半部分可以看出是向分液漏斗中加入水来检验的
(2)根据装置的特点及实验目的,分析鼓入空气这一操作的目的,为了排除空气中二氧化碳的干扰,要把二氧化碳除去,
(3)根据浓硫酸的作用及探究的内容来评价装置C对测定结果的影响
(4)分析实验前后装置D质量变化,并由此质量差计算样品中碳酸钠的质量,求出样品中碳酸钠的质量分数;
点评:本题主要考查二氧化碳和碱石灰的反应,通过本题我们要知道在完成实验时要尽可能的排除可能对实验结果产生影响的因素,例如本题中空气中二氧化碳对实验结果的影响,水蒸气的影响等.


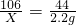 ,解得x=5.3g
,解得x=5.3g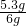 ×100%=88.3%
×100%=88.3%

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案