
【题目】正常情况下人的胃液PH为0.81.5 , 相应含HCl的溶质质量分数为0.2%0.4%,胃液中HCl过多与过少都不利于人体健康。某人出现反胃、吐酸水的症状,经检查其胃液中HCl的质量分数为1.495%(胃液密度约为1g/cm3)。
(1)正常情况下,人的胃液显________性。
(2)若人的胃液总量为100mL,正常人胃液中HCl的质量范围为________g。
(3)医生给患者开的药品为胃舒平(有效成分是Al(OH)3),每片胃舒平含Al(OH)3的质量为0.39g 。请根据化学方程式计箅该患者至少服用多少片的胃舒平,胃液才能恢复正常_____?(请写出计算过程)
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:初中化学 来源: 题型:
【题目】向一定质量FeCl2和CuCl2的混合溶液中加入锌粉,反应过程中,混合物中溶液的质量与加入锌的质量关系如图所示,该反应过程中混合物中的溶液和固体的有关说法正确的是
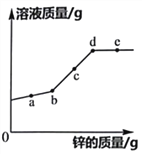
A. a点时,溶液中只含有两种溶质
B. c点时,向固体中滴加稀盐酸,无气泡产生
C. d点时,溶液中的溶质为ZnCl2
D. e点时,固体中只含两种物质
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某补钙药剂的标签主要内容如图所示,现测定该钙片含量是否符合标注,做如下实验:取10片该钙片,放入干燥、洁净的烧杯中,再向烧杯中加入50g某浓度稀盐酸,恰好完全反应(钙片中其他成分不溶于水,也不和稀
盐酸反应,反应中产生的气体全部放出),反应后称量烧杯内剩余物质的质量为64.5g.

(1)反应中生成二氧化碳质量;______
(2)通过计算说明每片钙片实际钙含量。说明是否与标注相符?______
(3)试计算所用稀盐酸的溶质质量分数.______
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】40℃时,将等质量的甲、乙固体分别放入各盛有100g水的两个烧杯中,充分搅拦后并降温至20℃,现象如左图所示,有关甲和乙的溶解度曲线如图所示。

(1)左上图中一定属于饱和溶液的是_____(填序号),烧杯①中溶解的溶质是_____(填甲或乙)
(2)20℃时140g甲的饱和溶液稀释成10%的溶液,需加水_____g;
(3)下列有关说法不正确的是_____
A 上图中A中上层溶液中溶质质量分数>B中溶液溶质质量分数
B 上图中B、C、D烧杯里的溶液都可能是饱和溶液
C 从甲、乙的饱和溶液中提纯乙可采用升温的方法
D 甲、乙的饱和溶液分别从40℃降温到20℃,得到的溶液中溶质质量分数相等
E 20℃时可用40%乙溶液稀释成10%的溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水消毒过程中常会发生如下化学反应,其反应的微观过程可用下图表示:
(“O’’表示氧原子,‘‘●”表示氢原子,“![]() ’’表示氯原子)
’’表示氯原子)
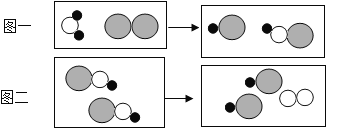
(1)上述图中所出现的物质中,共有___________种含有氧元素的化合物。
(2)从图中我们可知,在化学反应中,反应前后 _________个数不变。
(3)写出图一发生反应的化学方程式____________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上煅烧石灰石一段时间后,同学们取20g反应后的混合物,加入100g质量分数为15.6%的稀盐酸恰好完全反应,测得反应后的液体的质量为111.2g,得滤渣4.4g,则煅烧时分解的碳酸钙占原碳酸钙的质量分数为( )
A. 25%B. 50%C. 75%D. 20%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示为实验室中常见气体制备、净化、干燥、收集和性质实验的部分仪器。某化学兴趣小组同学欲利用其进行下列各探究实验。试根据题目要求,回答下列问题
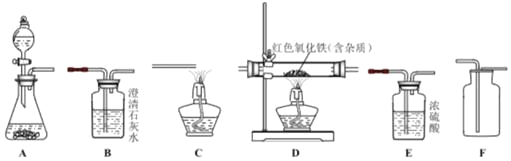
(1)该小组同学欲用过氧化氢溶液与二氧化锰制取并收集一瓶干燥的氧气。
①选仪器的连接顺序为A﹣___(填写仪器序号字母)。
②检验装置A气密性的方法是___。
③装置A中发生反应的化学方程式为___。
(2)该小组同学欲用足量纯净的一氧化碳气体测定某不纯的氧化铁样品的纯度(杂质不参加反应),并验证反应生成物的性质。所选仪器的连接顺序为:纯净的一氧化碳气体﹣D﹣B﹣C。
①仪器中B的现象是___。
②仪器C的作用是___。
③仪器D中的现象是___。
④通过测量反应前、后D处大玻璃管的质量变化,来计算氧化铁样品的纯度。若实验结束后大玻璃管中的物质里还有少许红色氧化铁,则计算出样品纯度的结果将___(填“偏大”,“偏小”或“不受影响”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】归纳总结是学习化学的重要方法,小明同学用图甲总结了NaOH的四条化学性质(即NaOH与四类物质能够发生化学变化)。


图甲 图乙
(1)为了验证反应①,小明将无色酚酞试液滴入NaOH溶液中,溶液变成_______色。
(2)依据反应②说明NaOH必须密封保存,否则在空气中会变质,其化学方程式为____
_ 。
(3)小明用微观示意图(如图乙)来说明反应③的发生。用化学方程式 。从该图中可以看出,反应后的溶液pH_______(填“>”、“<”或“=”)7。
(4)为了验证反应④能够发生,你选择的物质是_______(填序号)。
A.Na2CO3 B.HCl C.CuSO4 D.NaCl
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业盐酸中通常因溶有少量的 FeCl3而呈黄色,小红为测定某工业盐酸中 HCl 的含量进 行如下实验:取某工业盐酸 l00g,滴加一定溶质质量分数的 NaOH 溶液,测得加入 NaOH溶液质量与反应生成的沉淀质量关系如图所示,FeCl3与 NaOH 反应的化学方程式为FeCl3+3NaOH═Fe(OH)3↓+3NaCl.请回答下列问题:
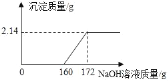
(1)FeCl3与 NaOH 恰好完全反应时,生成沉淀的质量是_____ g;
(2)所滴加的 NaOH 溶液质量为 160 克时,溶液中的溶质是_____;
(3)该工业盐酸中 HCl 的质量分数是多少?_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com