
分析 (1)化学反应遵循质量守恒定律,即反应前后元素种类不变,原子种类和总个数都不变;
(2)银不能和稀硫酸反应;
铁能和稀硫酸反应生成硫酸亚铁和氢气,锌能和硫酸亚铁反应生成硫酸锌和铁;
铁比铜活泼,铜比银活泼,铜与铁的混合物投入到一定量的AgNO3溶液中,铁先和硝酸银反应,如果硝酸银足量,则铜再和硝酸银反应.
解答 解:(1)由Na2Cr2O7+X=2CrO3+Na2SO4+H2O可知,反应前后钠原子都是2个,铬原子都是2个,反应后氧原子是11个,反应前应该是11个,其中4个包含在X中,反应后硫原子是1个,反应前应该是1个,包含在X中,反应后氢原子是2个,反应前应该是2个,包含在X中,因此X中含有2个氢原子、1个硫原子和4个氧原子,是硫酸,硫酸的化学式是H2SO4.
故填:H2SO4.
(2)铜与另一种金属M的混合物(M可能是Al、Fe或Ag),在该混合物中加入足量的稀硫酸有气泡产生,则M不可能是Ag,这是因为银不能和稀硫酸反应,待反应完成后过滤,在滤液中加入锌片,其表面有一层黑色物质,则M是Fe,这是因为铁能和稀硫酸反应生成硫酸亚铁和氢气,锌能和硫酸亚铁反应生成铁和硫酸锌,附着在锌表面的铁是黑色固体;
A.固体中一定有Ag,这是因为铁先和硝酸银反应生成了硝酸亚铁和银,该选项说法正确;
B.溶液中不一定有Ag+,这是因为如果硝酸银不足时溶液中不含有银离子,该选项说法不正确;
C.溶液中一定有铁的离子,并且是亚铁离子,这是因为铁先和硝酸银反应生成了硝酸亚铁和银,该选项说法正确;
D.固体中一定有铁和硝酸银反应生成的Ag,不一定有Cu,例如硝酸银过量时铜完全反应,该选项说法不正确.
故填:Ag;Fe;AC.
点评 要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.


科目:初中化学 来源: 题型:选择题
| A. | 53:40 | B. | 53:19 | C. | 53:80 | D. | 53:28 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NaHCO3是碱 | |
| B. | 该反应中四种物质都是盐 | |
| C. | 该反应不符合复分解反应发生的条件 | |
| D. | 析出晶体后剩余溶液中的溶质只有NH4Cl一种 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  水的电解 | |
| B. | 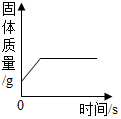 将一定质量硫酸铜溶液倒入盛有铁钉的烧杯 | |
| C. |  加热一定量KMnO4固体 | |
| D. | 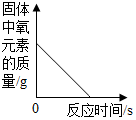 向少量的H2O2溶液中加入MnO2固体 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
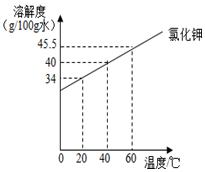 根据下表实验,回答相关问题
根据下表实验,回答相关问题| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 在盛有100g水的烧杯中,加入25g氯化钾,搅拌,恢复到20℃. | 全部溶解 |
| Ⅱ | 再加Xg氯化钾,搅拌,恢复到20℃,恰好饱和. | 全部溶解 |
| Ⅲ | 再加6g氯化钾,搅拌,恢复到20℃ | 固体不溶 |
| Ⅳ | 加热 | 全部溶解 |
| Ⅴ | 冷却至20℃ | 有固体析出 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 向一定量的NaOH溶液中通入CO2后再滴加稀盐酸,有气体生成 | |
| B. | 向装有一定量NaOH溶液的烧杯中滴几滴酚酞溶液,再逐滴加入稀盐酸 | |
| C. | 先测定NaOH溶液的pH,再逐滴加入稀盐酸,溶液的pH数值逐渐降低 | |
| D. | 向装有少量稀盐酸的试管中滴加足量NaOH溶液,再向其中滴加Na2CO3溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com