
【题目】用化学用语填空:
(1)2个硫酸根离子________; (2)体温计中(熔点最低)的金属元素是____________;
(3)标出氧化铁中铁元素的化合价_________;(4)3个氮分子________________;
(5)写出下列物质的名称
①FeCl2_______________;②(NH4)2SO4_____________;③HNO3______________。
科目:初中化学 来源: 题型:
【题目】【 2016届辽宁省丹东七中九年级第二次模拟】鉴别下列各组物质所选用试剂正确的是( )
A、稀盐酸和稀硫酸(紫色石蕊溶液) B、碳酸钠溶液和氯化钠溶液(硝酸银溶液)
C、氯化钠溶液和稀盐酸(金属铜) D、氢氧化钠溶液和澄清石灰水(碳酸钠溶液)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】p型透明导电化合物CuAlO2具有良好的热电性能,在热电转换领域具有广阔的应用前景。银铜合金广泛用于航空工业,以下为从航空切割废料中回收银并制备CuAlO2的工艺流程。

【资料】
Ⅰ.难溶性碱受热易分解为两种氧化物,Cu(OH)2、Al(OH)3完全分解的温度分别为80℃和450℃;
Ⅱ.CuAlO2高温易分解、受热易氧化。银在空气中不易被氧化。
请回答下列问题:
(1)CuAlO2中铜元素的化合价为______,过滤后所得滤液A中的溶质为__________。
(2)煮沸过程中发生反应的化学方程式为_____________________。
(3)固体B在煅烧时发生的其中一个反应方程式为4CuO + 2Al2O3 ![]() 4CuAlO2+X↑,气体X的化学式为__________。
4CuAlO2+X↑,气体X的化学式为__________。
(4) “煅烧”时温度须控制在1042—1085℃范围内且在氩气中进行,其原因是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两物质的溶解度曲线如图所示。下列叙述中正确的是

A.t1℃时,甲和乙的溶解度均为30
B.t1 ℃时,甲和乙的饱和溶液中溶质质量一定相等
C.t 2℃时, 分别在100 g水中各溶解20 g甲、乙,降温后,乙溶液的溶质质量分数可能会大于甲溶液的溶质质量分数
D.t2 ℃时,在100 g水中放入60 g乙,其溶质的质量分数为37.5%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】【2017届上海市金山区蒙山中学九年级上9月月考】下列四组混合物能按溶解、过滤、蒸发进行分离的是( )
A.铜粉和铁粉 B.蔗糖和泥沙 C.食盐和蔗糖 D.酒精和水
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究。
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【查阅资料】盐酸是由氯化氢和水组成,盐酸的浓度是指氯化氢在盐酸中所占的质量分数。
【作出猜想】a.可能与金属本身的性质有关;b.可能与盐酸的浓度有关。
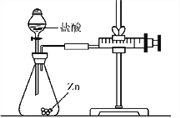
【设计探究】实验所用金属均已用砂纸打磨。
实验(1):为探究猜想a,常温下,小组同学分别在两支试管中放入相同形状、质量相等的锌片和铁片,然后分别加入质量相等、浓度相等的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡。请写出放锌片的试
管中发生反应的化学方程式:____。从实验现象可初步判断:金属活动性Zn____Fe(填“<”“=”或“>”)。
【得出结论1】金属与盐酸发生反应的剧烈程度与金属本身性质有关。
实验(2):为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是____________________。
【实验记录】实验数据如下表:
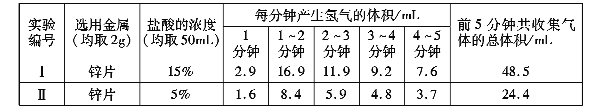
【得出结论2】金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是________________。
【反思评价】根据表中实验Ⅱ数据分析,请描述锌与盐酸发生反应快慢的变化情况并解释原因_______________________。通过以上探究,你认为金属与盐酸反应的剧烈程度可能还受哪些因素的影响?____________________(写一条即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】【2016年山东省济宁市】 随着人们生活水平的提高,小汽车走进了千家万户,车用防冻液“冬天防冻、夏天防沸、全年防水垢、防腐蚀”的优良性能被爱车族广泛使用,现国际上普遍使用的是乙二醇[(CH2OH)2]水基型防冻液,请回答:
(1)乙二醇的相对分子质量为 。
(2)乙二醇中C、H、O元素的质量比为 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】【 2017届山东省滨州地区九年级上学期10月月考】实验室配制100克5%的食盐溶液,
(1)需食盐的质量多少,水多少?
(2)若使其质量分数由5%的变成10%,需蒸发水的质量为多少?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“鱼浮灵”主要成分是过碳酸钠(xNa2CO3yH2O2),俗称固体双氧水。兴趣小组对其进行以下探究:
[性质探究]
(1)取少量“鱼浮灵”于试管中加水,有持续细小气泡缓慢放出;向试管中加入少量MnO2粉末,产生大量气泡。将带火星木条伸入试管,木条________,说明有O2生成。在该反应中,MnO2粉末的作用是______。
(2)取实验(1)中上层清液,测得溶液pH>7;向溶液中滴加足量稀盐酸,产生大量气泡;将产生的气体通入澄清石灰水中,出现浑浊现象,说明有__________生成。
结论:过碳酸钠具有Na2CO3和H2O2的双重化学性质。
[工业制备]
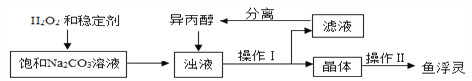
【查阅资料】异丙醇为有机溶剂,水与异丙醇可以互溶,过碳酸钠在异丙醇中溶解度较小。
(3)稳定剂中MgCl2和Na2SiO3发生复分解反应,生成一种难溶物将过碳酸钠粒子包裹住,该反应的化学方程式为_______________________。
(4)浊液中加入异丙醇的作用是______________________。
(5)操作Ⅱ中洗涤晶体的试剂最好选用___________(填字母)。
A.饱和NaCl溶液 B.水 C.异丙醇 D.稀盐酸
(6)根据下表数据,你认为上述制备反应的最佳温度范围是_________℃。
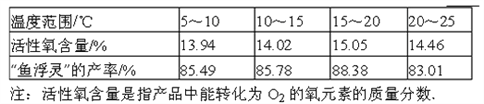
[组成测定]利用下图装置进行产品中活性氧含量测定和过碳酸钠(xNa2CO3yH2O2)组成的测定(杂质对测定无影响)。
查阅资料:①“鱼浮灵”中活性氧含量≥13.0%是一等品,≥10.5%是合格品。
②过碳酸钠能与酸反应放出CO2和O2。
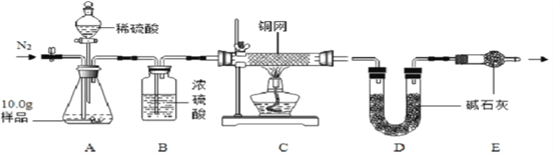
(7)实验前先缓慢通N2一段时间,加热铜网至红热后,再缓慢滴入过量稀硫酸,C装置中发生反应的化学方程式是__________________ ;A中样品完全反应后,继续缓慢通N2,其目的是_________________________。
(8)若先滴入稀硫酸,后加热铜网,会导致x:y的值________(填“偏大”或“偏小”)。
(9)装置B中浓硫酸的作用是________
(10)实验测得C装置中铜网增重1.2g,D装置增重2.2g。该产品中活性氧含量为______%;属于________(填“一等品”或“合格品”);x:y=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com