
分析 根据盐酸能清除铁锈、氢氧化钠能与非金属氧化物反应生成盐和水、在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,据此解答.
解答 解:(1)稀盐酸能与氧化铁反应,可以用于清除铁锈,故填:稀盐酸;
(2)氢氧化钠能与二氧化硫反应生成亚硫酸钠和水,故填:2NaOH+SO3═Na2SO4+H2O;
(3)向含有AgNO3、Cu(NO3)2的废水中加入一定量的锌粉,则锌先与硝酸银溶液反应,生成银,当硝酸银完全反应则锌与徐璈酸痛反应生成铜,故若是加入的锌粉量少,则只生成银;若是恰好与硝酸银和硝酸铜反应,则得到的金属是银和铜,若是金属过量,则得到的金属是银、铜和锌,故填:Ag;Ag、Cu;Ag、Cu、Zn.
点评 本题考查的是常见的酸碱以及金属与盐溶液的反应的知识,完成此题,可以依据已有的知识进行.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:初中化学 来源:【全国百强校】2017届宁夏银川市九年级下学期第一次模拟考试化学试卷(解析版) 题型:信息分析题
如图是某输液瓶标签上的部分内容。

由此可知,葡萄糖由________种元素组成,其中碳、氢、氧元素的质量比为___________,碳元素的质量分数为__________。在人体所需要的营养素中,葡萄糖属于__________。要把100g这种葡萄糖溶液稀释为2%的溶液,需要加水的质量为_________g。
查看答案和解析>>
科目:初中化学 来源:2017届江苏省九年级5月学情了解(二模)化学试卷(解析版) 题型:选择填充题
下列自然资源的开发利用中,一定涉及到化学变化的是
A. 从海水中提取食盐 B. 百炼成钢
C. 用分离液态空气的方法制氧气 D. 将石油分馏得到汽油、煤油等产品
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 序号 | 物质 | 杂质 | 试剂 | 除杂操作方法 |
| A | FeCl2溶液 | CuCl2 | 过量铁粉 | 结晶 |
| B | NaCl | KNO3 | 浓硫酸 | 洗气 |
| C | NaNO3溶液 | Na2CO3 | 适量CaCl2溶液 | 过滤 |
| D | 铜粉 | 铁粉 | 过量盐酸 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 钴与金属铜的化学性质相同 | |
| B. | 氢氧化钴能使无色酚酞试液变红色 | |
| C. | 氢氧化钴可用于干燥氯化氢气体 | |
| D. | 钴能与硫酸铜溶液反应,置换出金属铜 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 实验方案 | 使用的试剂 | 现象及结论 |
| A | 酚酞试剂 | 如果溶液不变色,表示盐酸已经过量 |
| B | 硫酸铜溶液 | 如果没有沉淀,表示盐酸已经过量 |
| C | 硝酸银溶液 | 如果有白色沉淀产生,表示盐酸已经过量 |
| D | 氧化铁粉末 | 如果溶液变黄色,表示盐酸已经过量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 青蒿素属于无机物 | |
| B. | 青蒿素的一个分子中含有42个原子 | |
| C. | 青蒿素的相对分子质量为282 | |
| D. | 青蒿素中碳元素的质量分数约为63.8% |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
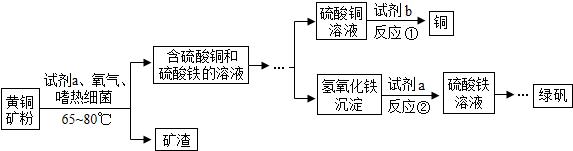
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com