
【题目】氯化钠是一种重要的盐,也是人生理活动必需的物质.根据所学知识回答:
(1)要检验生理盐水中的氯化钠,应选用的试剂是___(填化学式)溶液。
(2)可用NaOH除去粗盐中可溶性杂质MgCl2,反应的化学方程式为___。
(3)如图为一些物质的溶解度曲线,其中氯化钠的溶解度曲线的特点是_______;采用冷却结晶的方法,能从氯化钠混合溶液中分离出来的物质有_____(从如图的物质中选填)。
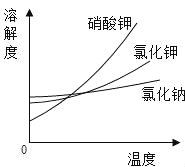
【答案】AgNO3 2NaOH+MgCl2=Mg(OH)2↓+2NaCl 氯化钠的溶解度受温度的影响变化不大 硝酸钾
【解析】
(1)氯化钠中的氯离子能够与硝酸银中的银离子结合生成氯化银的白色沉淀,所以可用硝酸银溶液来检验生理盐水中的氯化钠,硝酸银的化学式为AgNO3,故填AgNO3。
(2)氢氧化钠与氯化镁反应生成氯化钠和氢氧化镁沉淀,故反应的化学方程式写为:2NaOH+MgCl2=Mg(OH)2↓+2NaCl。
(3)由图可知,三种物质的溶解度均随温度升高而增大,但氯化钠的溶解度曲线比较平缓,表明氯化钠的溶解度受温度影响不大,故填氯化钠的溶解度受温度的影响变化不大;
冷却结晶适用于溶解度随温度升高而增大,且溶解度受温度影响较大的物质的结晶,三种物质中,硝酸钾的溶解度曲线最陡,说明硝酸钾的溶解度受温度影响最大,所以采用冷却结晶的方法,能从氯化钠混合溶液中分离出来的物质是硝酸钾,故填硝酸钾。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:初中化学 来源: 题型:
【题目】漂白粉的主要成分为次氯酸钙[Ca(ClO)2]和氯化钙,即可用作漂白剂,又可用作消毒剂。漂白粉中有效成分是[Ca(ClO)2],漂白的原理是:Ca(ClO)2在空气中发生反应![]() ;HClO是一种酸性比盐酸弱的酸,不稳定,具有漂白性,能使品红等有色物质褪色。
;HClO是一种酸性比盐酸弱的酸,不稳定,具有漂白性,能使品红等有色物质褪色。
(1)漂白粉是一种____________(填“纯净物”或“混合物”);
(2)HClO在常温下分解,反应为![]() 。某瓶HClO溶液放置一段时间后,溶液的pH值____________(填“增大”或“减小”或“不变”);
。某瓶HClO溶液放置一段时间后,溶液的pH值____________(填“增大”或“减小”或“不变”);
(3)在漂白粉中滴加盐酸,能加快漂白的速率。写出漂白粉中加入盐酸反应的化学方程式_______________。该反应的基本反应类型是____________反应;
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】草酸是生物体的一种代谢产物,广泛分布于植物、动物和真菌体中,并在不同的生命体中发挥着不同的功能。草酸晶体(H2C2O4﹒2H2O)无色,熔点为101 °C,易溶于水,受热易脱水、升华,170°C以上会分解。草酸能与氢氧化钙溶液反应生成草酸钙(CaC2O4)沉淀。请回答下列问题:
(1)甲组同学按照下图所示装置进行实验,检验草酸晶体的分解产物。加热装置应选用装置__________(选填“A”或“B”);装置C的主要作用是________________;观察到装置D中有气泡产生,澄清石灰水变浑浊,由此可知草酸晶体分解的产物中一定含有______________(填化学式)。

(2)乙组同学认为草酸晶体分解的产物中还有CO。为进行验证,选用上述实验中的发生装置和下图所示的部分装置(可以重复选用)进行实验。

①乙组同学的实验装置连接顺序应为发生装置→_______→______→_______→J→E→I。
②装置J中的氧化铁粉末的颜色发生了变化,欲证明草酸晶体分解的产物中有CO,乙组同学需要两次使用装置E,其现象分别是_________________。
③装置I的作用是_________________。
(3)根据上述实验探究,写出草酸晶体受热分解的化学方程式:_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在“宏观一微观”之间建立联系,是化学学科特有的思维方式。下图是某反应的微观示意图,下列有关该反应说法错误的是
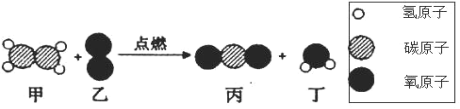
A. 反应前后原子个数不变B. 属于复分解反应
C. 生成的丙和丁的质量比为 22:9D. 反应前后分子个数不变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动。以下是教学片段,请你参与学习并帮助填写空格(包括表中空格)。
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的烧杯中。
【学生板演】该反应的化学方程式 。
Ⅰ.定性探究
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【猜 想】针对疑问大家纷纷提出猜想。甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的。你认为不合理的猜想是哪一种并说出理由 。
【继续实验】(1)丙组同学取烧杯中的少量溶液于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有 。
(2)为了验证其余猜想,各组同学取烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaC12溶液、Na2CO3溶液,分别进行如下三组探究实验。
实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
实验操作 |
|
|
|
实验现象 | 试纸变色,比照比色卡,pH<7 | 产生白色沉淀 | |
实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
【得出结论】通过探究,全班同学一致确定猜想二是正确的。
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定。同时指出上述三个实验探究中存在两处明显错误,请大家反思。同学们经过反思发现了这两处错误:
(1)实验操作中明显的一处错误是 ;
(2)实验方案探究中也有一个是不合理的,不合理的原因是 。
II.定量探究
取上述【演示实验】反应后烧杯中的溶液100 g,设计如下实验:
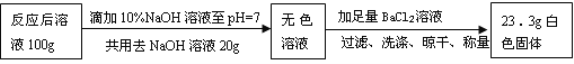
计算反应后溶液中Na2SO4的质量分数是多少?(请列出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是a、b两种固体物质(不含结晶水)的溶解度曲线。下列说法正确的是( )
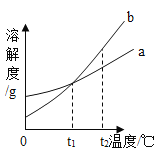
A.b的溶解度大于a的溶解度
B.t1℃时,将a、b两种物质的溶液分别恒温蒸发等质量的水,析出晶体的质量一定相等
C.将t2℃时b的不饱和溶液降温至t1℃,不一定能得到b的饱和溶液
D.t2℃时,a溶液的溶质质量分数一定小于b溶液的溶质质量分数
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在电缆生产过程中,不可避免地会产生一定量的含铜废料(废料中电缆皮和其它杂质不参与化学反应也不溶于水)。某化学兴趣小组的同学得知这一情况后,想回收利用含铜废料,根据工业制备硫酸铜的流程做了如下实验:
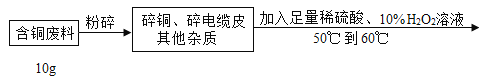

查阅资料:Cu+H2SO4+H2O2![]() CuSO4+2H2O
CuSO4+2H2O
(1)将废料粉碎的目的是_____;过滤操作中玻璃棒的作用:_____。
(2)滤液中硫酸铜的质量分数_____?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】亚硫酸钠在印染、造纸等众多行业中有着广泛的应用。某研究小组采用如图实验流程用Na2CO3溶液吸收SO2制备Na2SO3。

反应I中随着SO2的增加,依次发生如下化学反应:
SO+H2O+2Na2CO3=Na2SO3+2NaHCO3
SO2+2NaHCO3=Na2SO3+2CO2↑+H2O
SO2+H2O+Na2SO3=2NaHSO3
(1)H2SO3的名称为亚硫酸,则Na2SO3的名称为_____。
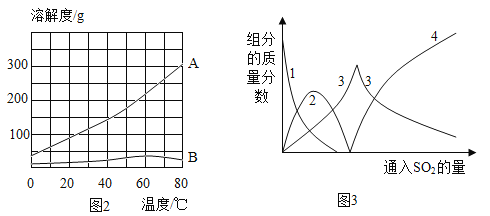
(2)常用蒸发结晶的方法分离混合溶液得到Na2SO3,由此可知,Na2SO3的溶解度曲线是与题图2中的_____(填A或B)物质的溶解度曲线相似。
(3)操作2得到的滤液中一定含有的溶质的化学式为_____。
(4)查阅资料可知,向碳酸钠溶液通入二氧化硫的过程中,溶液中有关组分的质量分数变化如图2所示。则线1表示_____(填化学式,下同)的质量分数的变化情况,线2表示_____的质量分数的变化情况。
(5)实验时,“反应Ⅱ”中加入NaOH溶液的目的是将反应1中生成的 NaHSO3转化为Na2SO3,则该化学反应方程式为_____。
(6)实验后,将Na2SO3样品放置在烧杯中,一段时间后,检测发现样品中出现Na2SO4杂质,且放置时间越长产生的Na2SO4越多,则Na2SO3样品变质为Na2SO4的化学反应方程式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,在乙瓶中放入用石蕊溶液染成紫色的干燥的纸花,在 A 处缓缓地持续通入混合气体 X,下表中的物质及实验操作后的现象对应关系不正确的是

选项 | 气体 X | 甲中盛放的溶液(足量) | 关闭Ⅰ阀打开Ⅱ阀 |
A | 潮湿的混有一氧化碳的二氧化碳 | 浓硫酸 | 纸花不变色 |
B | 干燥的混有一氧化碳的二氧化碳 | 氢氧化钠溶液 | 纸花变为红色 |
C | 潮湿且混有氯化氢的二氧化碳 | 氢氧化钠溶液 | 纸花不变色 |
D | 干燥且混有氯化氢的二氧化碳 | 饱和碳酸氢钠溶液 | 纸花变为红色 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com