
【题目】工业上用优质石灰石(含一定量SiO2)作原料制备高纯碳酸钙的过程如下图所示。
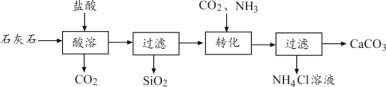
(1)“酸溶”过程中发生反应的化学方程式为______。
(2)SiO2中硅元素化合价为______。
(3)“转化”过程中参加反应的物质有______(填序号)。
A.CaCl2 B.NH3 C.CO2 D.H2O
科目:初中化学 来源: 题型:
【题目】以下是小明同学书写的部分化学用语,其中正确的是( )
①氖气---He ②五氧化二磷---O5P2 ③氯化铁---FeCl3 ④钠元素显+1价---Na+1
⑤两个铝离子---2Al3+
A. ①②④ B. ③⑤ C. ②③⑤ D. ②③④
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】质量守恒定律的定量研究对化学科学发展具有重大意义。
(1)下列各项中,在化学反应前后一定改变的是_______(填序号,多选、少选错选、均不给分)
①元素种类 ②物质的种类 ③原子的种类 ④分子种类 ⑤原子数目
(2)已知m1g镁条放在空气中完全燃烧,生成m2g氧化镁(不考虑其它反应),
小西在做该实验时,观察到耀眼的白光,冒出大量白烟,称量无误时,发现m1<m2,其原因是____。该反应______ (填“符合”或“不符合” ) 质量守恒定律
(3)下图为某化学反应的微观模拟图,“○”和“●”分别表示两种不同的原子:
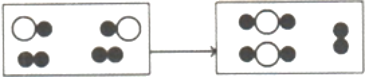
由![]() 聚集成的物质________(填“可能”或“不可能” )是氧化物, 参加反应的两种反应物的分子个数比为_____,此反应的基本反应类型为____。
聚集成的物质________(填“可能”或“不可能” )是氧化物, 参加反应的两种反应物的分子个数比为_____,此反应的基本反应类型为____。
(4)下列是初中化学中常见的实验。相关说法错误的是(填序号____)
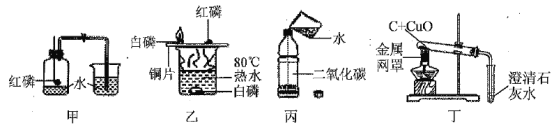
①甲实验的目的是测定空气中氧气的含量
②乙实验,水中的白磷没有燃烧,是因为温度没有达到着火点
③丙实验加水后,立即旋紧瓶盖,振荡,看到的现象是软塑料瓶向内凹陷
④丁实验,酒精灯上放的金属网罩是为了提高温度
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组学习酸、碱、盐性质后,通过实验对硫酸、氢氧化钙的化学性质进行了验证和总结,如图所示“——”表示物质两两之间能发生化学反应,请根据图,回答问题。
总结一:硫酸的化学性质
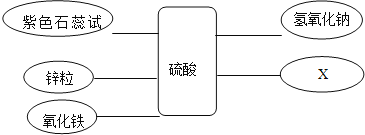
①写出氧化铁与硫酸的化学方程式______。
②补充一个实验,完善硫酸的化学性质,X可以是______(用化学式表示)。
③能发生中和反应的化学方程式______。
总结二:氢氧化钙的化学性质

(已知:CaCl2溶液呈中性,CaCl2+Na2CO3=CaCO3↓+2NaCl)
④乙同学将酚酞试液滴入氢氧化钙溶液中,观察到溶液变红,得出结论:氢氧化钙溶液呈______(填“酸性”、“碱性”或“中性”)。
⑤丙同学将过量的稀盐酸加入到乙同学所得溶液中,观察到红色褪去,此时所得溶液中含有的溶质有______(酸碱指示剂除外),请设计实验证明盐酸过量:______。
⑥丁同学将碳酸钠溶液加入滴有酚酞的氢氧化钙溶液中,充分反应后,观察到的现象:______; 反应后溶液中的溶质一定有______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种固体的溶解度曲线如图所示。下列说法不正确的是
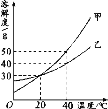
A. 20℃时,甲和乙两种物质的溶解度均为30 g
B. 40℃时,甲物质的溶解度比乙物质的溶解度大10 g
C. 将20℃时乙的饱和溶液升温至40℃,溶质质量分数不变
D. 将40℃时甲的不饱和溶液降温至20℃,溶液会变为饱和溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是一种宝贵的自然资源,当今世界淡水资源日趋紧张。下图是童童同学三月份为班级板报绘制的一幅画,她这样做的目的是_______。请你再写出一种符合画面主题的具体做法:_____________________。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图为某小组探究金属化学性质的两组实验。
实验I | 实验II |
|
|
①实验I中以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为该实验设计不够合理,理由是______________;
②写出实验II中C试管内反应的化学方程式_____________;
③实验II中要验证Cu、Fe、Ag的金属活动性顺序,至少要做的实验是_____(填字母序号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染。同学们对废旧手机中的金属回收产生兴趣。
【提出问题】从废旧手机中可以回收到哪些有价值的金属?如何回收?
【查阅资料】
Ⅰ.手机电路板中的金属及其价格如下表所示:
种类 | Fe | Cu | Al | Ni | Au | Ag | Pd(钯) |
市场价格/($/t) | 365 | 7175.5 | 1710.5 | 14235 | 4.7×107 | 7.6×105 | 2.7×107 |
矿石中含量 | 72.4 | 0.87 | 29.1 | 1.02 | 4 | 120 | 0.4 |
手机电路板中含量 | 5 | 13 | 1 | 0.1 | 350 | 1380 | 210 |
说明:Fe、Cu、Al、Ni的含量用质量分数(%)表示,Au、Ag、Pd的含量的单位为“g/t”。
Ⅱ.Ni的金属活动性位于氢前;Pd的金属活动性位于氢后;NiCl2溶液为绿色。
Ⅲ.2Cu + O2 + 2H2SO4 2CuSO4 + 2H2O
【实验方案】
第一步:选择值得回收的金属。
依据资料Ⅰ中的数据,废旧手机中有回收价值的金属有Au、Ag、Cu、Pd,原因是:①它们的市场价格较高;②________________。
第二步:设计实验分离、回收部分金属。
序号 | 实验步骤 | 实验现象 |
I | 取一废旧手机电路板,用电吹风机靠近电路焊接点的焊锡吹热风,一段时间后,用镊子将金属电路从塑料板中拽出 | 焊锡熔化 |
II | 将金属电路放入烧杯中,加入过量稀盐酸浸泡 | …… |
III | 取II中未溶解的金属电路,用蒸馏水洗净后,放入如图所示装置中,进行实验。
| 溶液逐渐变成蓝色,仍有微量金属固体未溶解 |
IV | 过滤III中烧杯中的物质,洗涤滤纸上的物质 | 滤纸上仍有微量金属固体 |
V | …… | …… |
【问题讨论】
⑴ 由步骤I中的现象,可推知的焊锡的物理性质是________;
⑵ 步骤II对应的实验现象是________________;
⑶ 步骤II所得溶液中,至少含有溶质有______种;
⑷ 步骤V的操作是:“向步骤Ⅳ获得滤液中加入一定量铁粉”,若该实验过程加入铁粉前后溶液中主要离子变化示意图如图所示。
① 图中“![]() ”所代表微粒的符号为________;
”所代表微粒的符号为________;
② 充分反应后过滤,滤纸上固体物质是________(写化学式)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组为测定某石灰石样品中碳酸钙的质量分数,取2.6g石灰石样品放在烧杯中,然后向其中逐渐加入稀盐酸,使之与样品充分反应,恰好完全反应(杂质不参加反应)时,加入稀盐酸的质量为9.0g,反应后烧杯中物质的总质量为10.5g。请计算:
(1)反应生成二氧化碳的质量________。
(2)样品中碳酸钙的质量分数_________。(结果保留到0.1%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com