


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源:2012年初中毕业升学考试(江苏扬州卷)化学(解析版) 题型:填空题
碘酸钾(KIO3)主要用作食盐加碘剂
Ⅰ、制备碘酸钾
实验室制备碘酸钾的路线如下:

(1)KIO3中I的化合价为 ,含碘盐中的碘是指 (填字母)。
a、离子 b、元素 c、分子
(2)实验中需要用试纸测定溶液的PH,其操作方法是 。
(3)过滤操作需要的玻璃仪器有玻璃棒、烧杯和 。
(4)用冰水洗涤过滤所得KIO3晶体,其原因是 。
(5)温度过高,会造成H2O2利用率降低,可能的原因是 。
Ⅱ测定碘含量
资料:①碘酸钾与碘化钾反应方程式为:KIO3+5KI+3H2SO4===3K2SO4+3H2O+3I2
②淀粉溶液遇碘显色时,碘浓度越大颜色越深;
③扬州作为轻度缺碘地区,食盐中碘含量(以I计)应为18~33mg/Kg
步骤1:配置以下各种试剂:100g/L食盐溶液,2.14*10-3g/L KIO3溶液,测试液(含10g/L淀粉、196g/L H2SO4、1.66g/L KI)。
步骤2:取5支相同规格小试管,贴上编号标签,按下表要求分别依次加入步骤1中配置的KIO3溶液,测试液、蒸馏水,塞上橡皮塞,混合后有序放置在试管架上(各试管中KIO3完全反应)。
|
试管编号 |
1 |
2 |
3 |
4 |
5 |
|
KIO3溶液滴数 |
30 |
25 |
20 |
15 |
10 |
|
测试液滴数 |
10 |
10 |
10 |
10 |
10 |
|
蒸馏水滴数 |
0 |
5 |
10 |
15 |
20 |
步骤3:另取一支小试管,一次加入步骤1中所配置的食盐溶液10滴、测试液10滴、和蒸馏水20滴,混合后与步骤2中各试管内颜色对照。
(6)步骤3所得溶液呈 色,则说明该食盐是含碘盐。
(7)步骤2实验的目的是 ,步骤2中测试液的滴数保持一致的原因是 。
(8)若步骤3所得溶液颜色与3号试管一致,则100ml该食盐溶液中含有碘酸钾 mg。该食盐中碘含量为 mg/Kg, 扬州地区要求(填“符合”或“不符合”)。
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
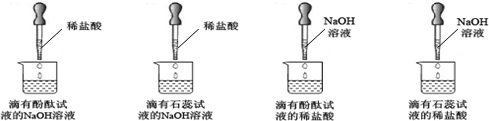
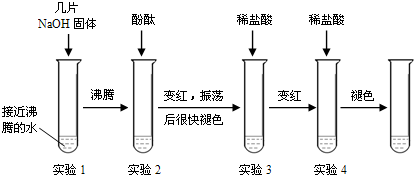
| 紫色石蕊试液 | pH<5.0:红色 | 5.0<pH<8.0:紫色 | pH>8.0:蓝色 |
| 无色酚酞试液 | pH<8.2:无色 | 8.2<pH<10.0:红色 | pH>10.0:无色 |
| 温度/°C | 10 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 64 | 85 | 138 | 203 | 285 | 376 |
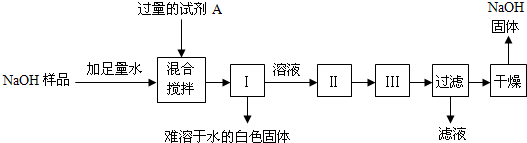
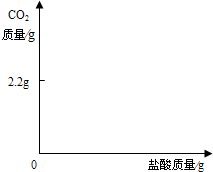
查看答案和解析>>
科目:初中化学 来源:2011年江苏省扬州中学教育集团树人学校中考化学模拟试卷(6月份)(解析版) 题型:解答题
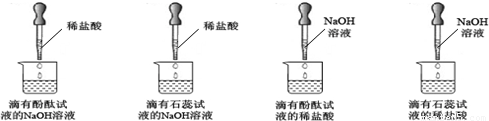
| 紫色石蕊试液 | pH<5.0:红色 | 5.0<pH<8.0:紫色 | pH>8.0:蓝色 |
| 无色酚酞试液 | pH<8.2:无色 | 8.2<pH<10.0:红色 | pH>10.0:无色 |
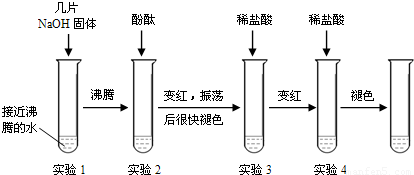
| 温度/°C | 10 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 64 | 85 | 138 | 203 | 285 | 376 |
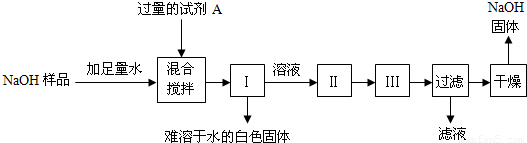
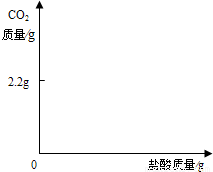
查看答案和解析>>
科目:初中化学 来源:2012年福建省泉州市中考化学试卷(样卷)(解析版) 题型:解答题
| 农作物 | 茶树 | 烟草 | 水稻 | 甘草 |
| pH | 5.0~5.5 | 5.0~6.0 | 6.0~7.0 | 7.2~8.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com