
【题目】某课外活动小组拟用下列装置做炼铁原理的实验,同时检测氧化铁矿的纯度(假设矿石不含其他与 CO 反应的成分),并除去尾气。CO 用H2C2O4(乙二酸)来制取: 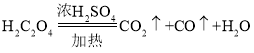 。与Fe2O3反应的 CO 需纯净、干燥。
。与Fe2O3反应的 CO 需纯净、干燥。
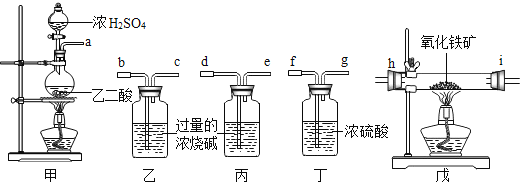
(1)若所制的气体的流向为从左向右时,下列仪器组装连接的顺序是(用 a,b……表 示):________;
(2)实验结束后,先熄灭________处的酒精灯,再熄灭_________处的酒精灯;
(3)为了保护环境,怎样处理仪器末端导出的 CO(写出具体方法):______ ;
(4)实验前氧化铁矿粉末的质量为 ag,实验后测得乙和丙的质量分别增加了 yg 和 zg, 则可依上述数据计算氧化铁矿粉末中氧化铁的质量分数。但按此方法实际实验测定结果可能偏大,造成这种误差的原因可能是 ______,也可能偏小,造成这种误差的原因可能是 ______。若要消除上述误差,要求不要添加其他实验装置,且实验装置连接顺序不变,你认为应如何改进实验 _______。
【答案】abcfghide 或 adefghibc 戊 甲 点燃 (或用气囊收集) 除去 CO 中 CO2 的装置吸收 CO2 不充分,吸收 CO 与 Fe2O3 反应生成的CO2 的装置吸收了空气中的 CO2 CO 与 Fe2O3反应生成的 CO2 未被 NaOH完全吸收 称取氧化铁样品的质量,完全反应并冷却后再称量剩余固体的总质量。通过计算得氧化铁样品中氧化铁的质量分数,可消除误差。
【解析】
(1)要得到纯净干燥的一氧化碳,首先要通过烧碱除去一氧化碳中的二氧化碳,因为氢氧化钠能与二氧化碳反应生成碳酸钠和水,氢氧化钠与一氧化碳不反应,且洗气应“长进短出”,然后通过浓硫酸除去一氧化碳中的水分,因为浓硫酸具有吸水性,且不与一氧化碳反应,然后一氧化碳与氧化铁反应生成铁和二氧化碳,然后通过浓氢氧化钠溶液,让浓氢氧化钠溶液吸收二氧化碳,通过氢氧化钠溶液的增加量得出生成二氧化碳的质量,然后通过二氧化碳的质量计算出氧化铁的质量,从而计算出铁矿石的纯度,因此装置连接顺序应是abcfghide或adefghibc;
(2)反应结束时还原出的铁单质高温下还可以与O2反应,所以应使Fe在CO的还原性气氛中慢慢冷却,才能防止再被氧化,故先熄灭戊处的酒精灯,再熄灭甲处的酒精灯;
(3)因为一氧化碳还原氧化铁实验结束时还要继续通一氧化碳直到玻璃管冷却,一氧化碳有剧毒,不能直接排放到空气中,为了保护环境,所以将排出的CO点燃;
(4)根据反应的化学方程为3CO+Fe2O3![]() 2Fe+3CO2可知,通过测定氢氧化钠溶液吸收生成二氧化碳前后的质量差来计算氧化铁样品中氧化铁的质量分数,测得二氧化碳的质量越大,结果偏大,反之,就偏小;再结合
2Fe+3CO2可知,通过测定氢氧化钠溶液吸收生成二氧化碳前后的质量差来计算氧化铁样品中氧化铁的质量分数,测得二氧化碳的质量越大,结果偏大,反之,就偏小;再结合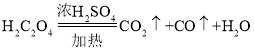 ,分析可知:除去 CO 中CO2的装置吸收CO2不充分或吸收 CO 与Fe2O3反应生成的CO2的装置吸收了空气中的CO2,会导致结果偏大;CO 与Fe2O3反应生成的CO2未被 NaOH完全吸收,会导致结果偏小;若要消除误差,可以通过测定玻璃管中固体在反应前后的质量差,来计算氧化铁样品中氧化铁的质量分数,具体如下:称取氧化铁样品的质量,完全反应并冷却后再称量剩余固体的总质量;通过计算得氧化铁样品中氧化铁的质量分数即可。
,分析可知:除去 CO 中CO2的装置吸收CO2不充分或吸收 CO 与Fe2O3反应生成的CO2的装置吸收了空气中的CO2,会导致结果偏大;CO 与Fe2O3反应生成的CO2未被 NaOH完全吸收,会导致结果偏小;若要消除误差,可以通过测定玻璃管中固体在反应前后的质量差,来计算氧化铁样品中氧化铁的质量分数,具体如下:称取氧化铁样品的质量,完全反应并冷却后再称量剩余固体的总质量;通过计算得氧化铁样品中氧化铁的质量分数即可。


科目:初中化学 来源: 题型:
【题目】(1)请结合如图所示实验回答问题:
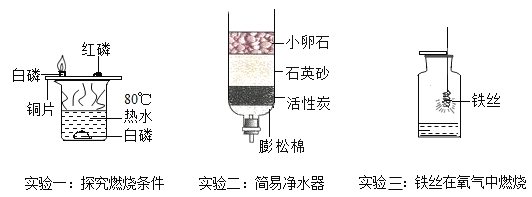
①实验一铜片上的白磷燃烧红磷不燃烧,说明燃烧的条件之一是______。
②实验二活性炭具有______、过滤作用。
③实验三集气瓶中水的作用是______。
(2)下列各组物质的鉴别或除杂方法![]() 括号内是杂质
括号内是杂质![]() 均正确的是______
均正确的是______![]() 用字母作答
用字母作答![]() 。
。
选项 | 物质 | 方法 |
A |
| 通过灼热的氧化铜 |
B |
| 加无色酚酞试液 |
C |
| 加水溶解、过滤 |
D |
| 加入适量的氢氧化钠溶液、过滤 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】取一定质量的碳酸钙固体高温灼烧一定时间,测得反应后剩余固体质量为8.8g,其中钙元素质量分数为50%,则下列说法中符合事实的是( )
A.碳酸钙固体高温灼烧发生了氧化反应
B.反应前碳酸钙固体的质量为11g
C.生成CO2气体的质量为2.2g、
D.反应后剩余固体中氧化钙质量为5.6g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知NaHS、MgSO4、NaHSO3组成的混合物中,硫元素的质量分数为a%,则混合物中氧元素的质量分数为
A. a% B. 2a% C. (100-1.75a)% D. (1-0.75a)%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某种天然碱样品的化学式可以用xNaHCO3·yNa2CO3·zH2O表示(式中x、y、z是 最简整数比)。取50g某一浓度的盐酸与3.32g样品充分反应,能生成1.32gCO2气体。
(1)若改用1.66g样品与50g这种盐酸反应,能产生 gCO2。
(2)另取3.32g样品在300℃下加热至完全分解(已知:![]() , Na2CO3在300℃时不会分解),能产生0.22gCO2和0.45gH2O,试确定该样品的化学式: 。
, Na2CO3在300℃时不会分解),能产生0.22gCO2和0.45gH2O,试确定该样品的化学式: 。
(3)写出这种天然碱与盐酸完全反应的化学方程式。若6.64g天然碱样品与50g该盐酸能恰好完全反应放出,求该盐酸的溶质质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氢气是使用较为广泛的气体,从人类的最初接触到现在的广泛应用,经历了科学家们两百多年的努力探索。
(1)氢气的发现。16世纪,瑞士医生帕拉塞斯发现铁屑与硫酸接触产生一种气体,反应的化学方程式为____________________。英国科学家卡文迪许发现这种气体和空气混合后会产生猛烈爆炸,可燃性气体在点燃前需要____________________,他将这种气体命名为“可燃性气体”,并发现其充入动物膀胱后,动物膀胱会慢慢升空。这些研究引起了英国科学家普利斯特里的关注,他将氢气和空气混合,用电火花引爆,发现生成了水。
(2)氢元素的发现。拉瓦锡深入研究了前人的研究后,将这种气体命名为氢气,将对应元素命名为氢元素,并就此创立氧化学说。
(3)电解水实验。英国科学家卡里斯尔等用伏打电池电解水获得成功,进一步证明了拉瓦锡的结论。我们利用霍夫曼水电解器(如图所示)研究水的组成。
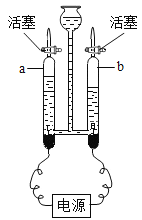
①a端产生的气体为________。
②电解水的实验结论为_______。
③若想研究水分子中的氢、氧原子个数比,还需提供的数据是___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是生命之源,下列关于水说法不正确的是( )
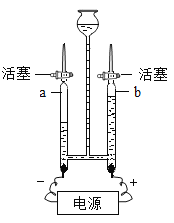
A.爱护水资源,一方面要防治水体污染,另一方面要节约用水
B.“直饮水机”可将自来水净化为饮用水,其内部使用的活性炭主要起吸附作用
C.生活中常用肥皂水检验饮用水是硬水还是软水;常用煮沸的方法降低水的硬度,并起到消毒杀菌的作用
D.如图为电解水的实验装置图。通电一段时间后,玻璃管 b中收集到的气体是氢气
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种固体物质的溶解度曲线如图所示。下列叙述中正确的是( )
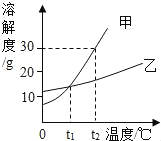
A. 甲物质的溶解度大于乙物质的溶解度
B. t1℃时,甲、乙两物质饱和溶液的溶质质量一定相等
C. t2℃时,将20g乙物质放入100g水中,所得溶液的质量为120g
D. t2℃时,等质量甲、乙两物质的饱和溶液降温到t1℃,析出晶体质量甲>乙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】探究反应物浓度对硫代硫酸钠(Na2S2O3)与硫酸反应速率的影响。
(查阅资料)
a Na2S2O3易溶于水,能与硫酸发生反应:![]()
b 浊度计用于测量浑浊度。产生的沉淀越多,浑浊度(单位为NTU)值越大。
(实验过程)
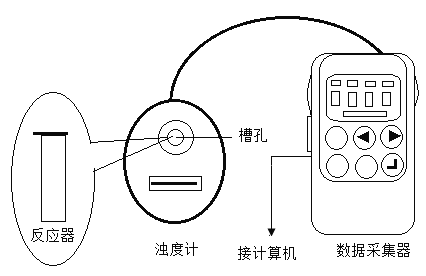
20℃时,用图所示装置进行如下表所示的5个实验,分别测量混合后溶液达到相同浑浊度的过程中,浑浊度随时间的变化。实验①~⑤所得数据如图所示。
实验编号 | 1.6% Na2S2O3溶液体积/ mL | 1% H2SO4溶液体积/ mL | 水体积/ mL |
① | 1.5 | 3.5 | 10 |
② | 2.5 | 3.5 | 9 |
③ | 3.5 | 3.5 | x |
④ | 3.5 | 2.5 | 9 |
⑤ | 3.5 | 1.5 | 10 |
注:所用溶液的密度均按1 g/mL计。
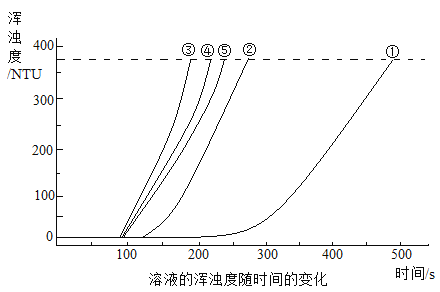
(解释与结论)
(1)选用浊度计进行测量,原因是Na2S2O3溶液与H2SO4溶液反应生成了_______。
(2)实验①~⑤中,反应速率最快的是_______(填实验编号)。
(3)实验③中,x=_______。
(4)实验①、②、③的目的是_______。
(5)比较①、②、③与③、④、⑤两组实验,可推断:改变_______(填“A”或“B”)对Na2S2O3与硫酸反应速率的影响更大。
A Na2S2O3溶液浓度
B H2SO4溶液浓度
你推断的证据是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com