
| 0.3m |
| 2.145m |



 星级口算天天练系列答案
星级口算天天练系列答案科目:初中化学 来源: 题型:
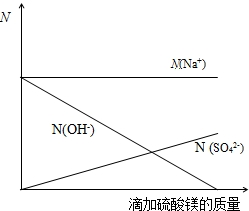
| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | 第六次 | |
| 加入稀硫酸的质量/g | 20 | 20 | 20 | 20 | 20 | 20 |
| 充分反应后剩余固体的质量/g | 8 | 6 | 4 | 3 | 3 | m |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
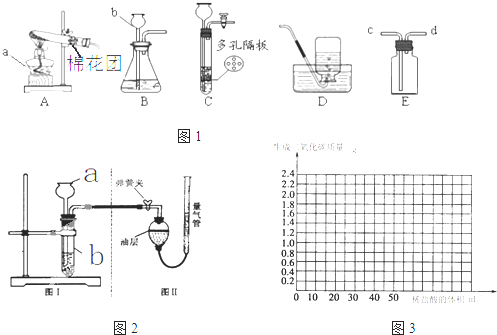
| ||
| ||
| ||
| ||
| 甲 | 乙 | |
| 实验过程 | 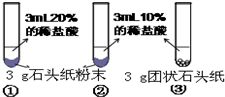 |
 |
| 现象 | 试管①、②、③中产生气泡快慢的顺序为: ①>②>③. |
|
| 分析结论 | Ⅰ碳酸钙与稀盐酸反应的化学方程式为 CaCO3+2HCl═2CaCl2+H2O+CO2↑ CaCO3+2HCl═2CaCl2+H2O+CO2↑ Ⅱ对比甲同学实验①②可知, 盐酸越浓(溶质的质量分数越大) 盐酸越浓(溶质的质量分数越大) ,化学反应的速度越快;Ⅲ对比甲同学实验 ②③ ②③ (填实验序号)可知,反应物的接触面积越大,反应速率越快 快 .Ⅳ乙同学的实验中,数据记录纸上应该连续记录的实验数据是 时间 时间 和锥形瓶及药品的质量或二氧化碳的质量 锥形瓶及药品的质量或二氧化碳的质量 . | |
| 第一份 | 第二份 | 第三份 | 第四份 | |
| 取样品质量(g) | 6.25 | 6.25 | 6.25 | 6.25 |
| 取稀盐酸的体积(mL) | 10.0 | 20.0 | 30.0 | 40.0 |
| 产生气体的质量(g) | 0.88 | 1.76 | 2.20 | m |


查看答案和解析>>
科目:初中化学 来源: 题型:
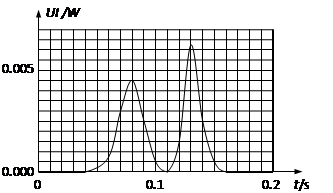
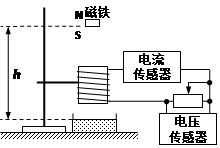
| A.线圈中的磁通量变化率经历先增大后减小再增大再减小的过程 |
| B.如果滑片从中间向左移动时,坐标系中的两个峰值一定都会减小 |
| C.磁铁在穿过线圈过程中加速度始终小于重力加速度g |
| D.如果仅略减小h,两个峰值都会减小 |
查看答案和解析>>
科目:初中化学 来源:2013年第二十三届“天原杯”全国初中学生化学素质和实验能力竞赛(天津赛区)初赛试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com