
分析 氢氧化钠吸收二氧化碳后生成碳酸钠,碳酸钠与稀硫酸反应可生成硫酸钠、水和二氧化碳,而氢氧化钠虽可与稀硫酸反应但却不放出气体;因此,反应后所剩余溶液的质量小于反应前各物质的质量和,反应前后的质量差即为放出的二氧化碳气体的质量;根据碳酸钠与硫酸反应的化学方程式,利用反应放出的二氧化碳的质量可计算参加反应的碳酸钠的质量;样品质量与碳酸钠的质量差即为未变质的氢氧化钠的质量,所计算的氢氧化钠质量与样品质量比即样品中氢氧化钠的质量分数
分析反应的化学方程式,①CO2+2NaOH=Na2CO3+H2O,②Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,综合①②,可得:2NaOH+H2SO4=Na2SO4+2H2O,所以NaOH部分变质或全部变质,与没有变质的NaOH相比,中和反应时消耗稀硫酸的量相等.
解答 解:(1)设样品中碳酸钠的质量为x,硫酸钠质量为y,
Na2CO3+H2SO4═Na2 SO4+H2O+CO2↑
106 142 44
x y 4.4g
$\frac{106}{x}=\frac{44}{4.4g}$,$\frac{142}{y}=\frac{44}{4.4g}$,解得x=10.6g,y=14.2g,
样品中氢氧化钠的质量26.6g-10.6g=16g,
答:样品中氢氧化钠的质量16g;
(2)设氢氧化钠与硫酸反应生成的硫酸钠是zg,
2NaOH+H2SO4=Na2SO4+2H2O
80 142
16g z
$\frac{80}{16g}=\frac{142}{z}$,解得:z=28.4g,
恰好完全反应后,溶液中溶质的质量分数为:$\frac{14.2g+28.4g}{26.6g+210g+200g-4.4g}×100%$=9.8%
答:溶液中溶质的质量分数为9.8%.
点评 利用质量守恒定律,根据反应前后小烧杯内物质的质量差,可得完全反应放出二氧化碳气体的质量;然后利用二氧化碳的质量,结合反应的化学方程式,可计算参加反应的碳酸钠的质量


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
| A. | 厕所清洁剂(pH=3) | B. | 洗发精(pH=8) | C. | 洗衣液(pH=10) | D. | 厨房清洁剂(pH=13) |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
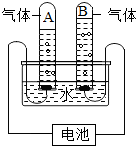 如图为水的电解实验,关于该实验的说法正确的是( )
如图为水的电解实验,关于该实验的说法正确的是( )| A. | 试管A中得到的是O2 | |
| B. | 试管B中的电极接电源的负极 | |
| C. | 试管A、B中所得气体的质量比为8:1 | |
| D. | 该实验说明水是由氢元素和氧元素组成 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用点燃的方法可彻底除去二氧化碳中少量的一氧化碳:2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2 | |
| B. | 不能用铁制容器配制波尔多液:2Fe+3CuSO4═Fe2(SO4)3+3Cu | |
| C. | 用稀盐酸除去铁锈的原理:6HCl+Fe2O3═2FeCl3+3 H2O | |
| D. | 医疗上用氢氧化镁中和胃酸过多:Mg(OH)2+H2SO4═MgSO4+2H2O |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 尽管水分子很小,但它是由更小的微粒构成的 | |
| B. | 在淡水资源缺乏的海岛上,可以用蒸馏法从海水中提取淡水 | |
| C. | 水是光合作用的原料,白天植物吸收的大量水主要用于光合作用 | |
| D. | 将自来水蒸干后会留下白渍,说明自来水不是纯净物 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用加热的方法区别热塑性塑料和热固性塑料 | |
| B. | 用稀盐酸区别小苏打和食盐 | |
| C. | 用石蕊溶液区别盐酸、苏打水和食盐水 | |
| D. | 用水区别碳酸钙和硫酸钡 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com