
【题目】铁是目前世界上使用最多的金属。
(1)认识铁:从宏观看,铁由_____组成;从微观看,铁由_____构成。
(2)实验室:细铁丝在氧气中燃烧的现象是_____,放热。该反应的化学方程式是_____。
(3)工业上:用一氧化碳和赤铁矿(主要成分是![]() )炼铁的化学方程式是_____。
)炼铁的化学方程式是_____。
科目:初中化学 来源: 题型:
【题目】如图是初中化学常见物质间的转化关系。F、G是组成元素相同的两种气体,Q、R都是黑色固体,E是生活中常用的调味剂、防腐剂(部分反应条件和产物略去)。以下说法错误的是
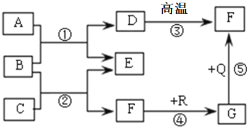
A. 反应④为吸热反应
B. D在一定条件下可以转化成A
C. 图中涉及的物质类别有单质、氧化物、酸、碱、盐
D. 图中反应的基本类型有分解反应、化合反应、复分解反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知A、B、C三种物质的溶解度曲线如图所示。
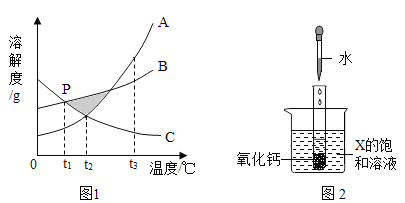
(1)t1℃时,A、B、C溶解度大小关系为______。
(2)若饱和B溶液中含有少量的C,提纯B的方法为______结晶,过滤。
(3)t2℃,将A、B、C的饱和溶液升温至t3℃,所得溶液溶质的质量分数大小关系为______。
(4)向试管中滴入2mL水后,若X中有固体析出,则X为______(选填“A、B、C”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某NaCl样品中混有杂质MgCl2,为了测定样品中MgCl2的质量分数。取固体样品50.0g完全溶解于水中,并向其中逐渐加入NaOH溶液,实验过程中生成沉淀的质量与加入NaOH溶液的质量的关系如下图所示:
注:发生反应的化学方程式为MgCl2+2NaOH==Mg(OH)2↓+2NaCl
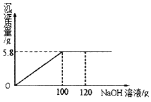
请根据相关信息完成下列计算:
(1)反应完全时生成氢氧化镁的质量_______g。
(2)样品中氯化镁的质量分数。_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】超细碳酸钙可用于生产钙片、牙膏等产品。利用碳化法生产超细碳酸钙的主要流程示意如图:
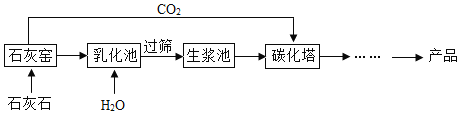
(1)石灰窑中发生的反应是______(“吸热”或“放热”)反应。
(2)乳化池中,生石灰与水发生的反应类型是______。
(3)过筛的目的是拦截大于筛孔直径的颗粒,实验室中常用过滤来分离不溶于水的固体。过滤操作中需要用到玻璃仪器有玻璃棒的作用是______。过滤后滤液依然浑浊的原因可能是______。
(4)碳化塔中反应的化学方程式为______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】对比实验、控制变量是学习化学的重要方法,下列对比实验不能达到目的的是( )
编号 | A | B | C | D |
实验设计 |
|
|
|
|
实验目的 | 探究 | 探究物质燃烧的条件 | 探究生锈条件 | 探究 |
A. A B. B C. C D. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组欲测定一瓶过氧化氢溶液![]() 过氧化氢和水的混合物
过氧化氢和水的混合物![]() 中过氧化氢的质量,实验操作及相关数据如图所示:
中过氧化氢的质量,实验操作及相关数据如图所示:
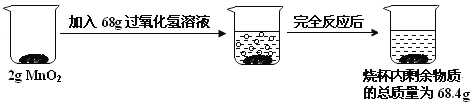
(1)生成氧气的质量______g,计算的依据是______
(2)这瓶过氧化氢溶液中过氧化氢的质量是_______?![]() 请根据方程式计算
请根据方程式计算![]()
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】对销售的KCl钾肥,国家有明确的质量要求,其中KCl的含量不低于83.4%。某兴趣小组对市售的某钾肥进行了检测,称取1.6g样品放入烧杯中,加入适量的水溶解后,逐滴加入5%AgNO3的溶液,产生沉淀的质量与所加入AgNO3溶液质量的关系如图1所示(假定杂质不参加反应)。
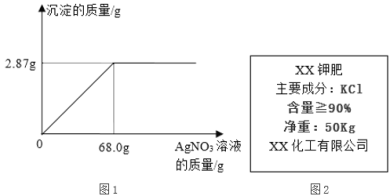
(1)68.0gAgNO3溶液中所含溶质的质量为_____g。
(3)通过计算,判断该钾肥中KCl的质量分数是否符合图2的包装说明?_____(写出计算过程)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染。同学们对废旧手机中的金属回收产生兴趣。
(提出问题)
从废旧手机中可以回收到哪些有价值的金属?如何回收?

(查阅资料)
Ⅰ.手机电路板中的金属及其价格如下表所示:
种类 | Fe | Cu | Al | Ni | Au | Ag | Pd(钯) |
市场价格/($/t) | 365 | 7175.5 | 1710.5 | 14235 | 4.7×107 | 7.6×105 | 2.7×107 |
矿石中含量 | 72.4 | 0.87 | 29.1 | 1.02 | 4 | 120 | 0.4 |
手机电路板中含量 | 5 | 13 | 1 | 0.1 | 350 | 1380 | 210 |
说明:Fe、Cu、Al、Ni的含量用质量分数(%)表示,Au、Ag、Pd的含量的单位为“g/t”。
Ⅱ.Ni的金属活动性位于氢前;Pd的金属活动性位于氢后;NiCl2溶液为绿色。
(实验方案)

第一步:选择值得回收的金属。
依据资料Ⅰ中的数据,废旧手机中有回收价值的金属有Au、Ag、Cu、Pd,
(1)原因是:①它们的市场价格较高;②_____。
第二步:设计实验分离、回收部分金属。
序号 | 实验步骤 | 实验现象 |
Ⅰ | 取一废旧手机电路板,用电吹风机靠近电路焊接点的焊锡吹热风,一段时间后,用镊子将金属电路从塑料板中拽出 | 焊锡熔化 |
Ⅱ | 将金属电路放入烧杯中,加入过量10%的稀盐酸浸泡 | …… |
Ⅲ | 取Ⅱ中未溶解的金属电路,用蒸馏水洗净后,放入如上图所示装置中,进行实验。 | 溶液逐渐变成蓝色,仍有微量金属固体未溶解 |
Ⅳ | 过滤Ⅲ中烧杯中的物质,洗涤滤纸上的物质 | 滤纸上仍有微量金属固体 |
(问题讨论)
(2)由步骤I中的现象,可推知的焊锡的物理性质是_____(填字母)。
a.熔点低 b.硬度大 c.抗腐蚀性强
(3)步骤Ⅱ中实验室用溶质质量分数为37%、密度是1.18gmL-1的浓盐酸配制10%的盐酸185g,需要浓盐酸_____ml;配制该稀盐酸应选择的量筒量程(水的密度为1g/cm3)为_____(填字母)。
a.10ml b.50ml c.100ml d.200ml
(4)步骤Ⅱ所得溶液中,至少含有_____(填数字)种溶质,该步骤中对应的实验现象是_____。
(5)请写出步骤Ⅲ中,溶液变成蓝色的化学方程式_____。
(6)步骤Ⅳ中过滤操作用到的玻璃仪器有玻璃棒、_____和_____,其中玻璃棒的作用是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com