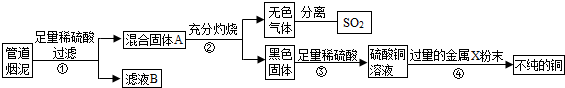
(2013?江宁区二模)某金属冶炼厂的管道烟泥中含有炭黑及金属铜、锌、硫.综合实践活动小组的同学设计了从管道烟泥中回收金属铜并利用废气中的二氧化硫制备硫酸的实验方案,实验过程如图所示:
请回答:
(1)步骤①中,过滤操作使用了玻璃棒,其作用是
引流
引流
;如何确定硫酸已经过量
取少量滤液放入试管内,向试管内加入锌粒,如果有气泡产生,说明加入的硫酸是过量的,如果没有气泡产生,说明硫酸没有过量
取少量滤液放入试管内,向试管内加入锌粒,如果有气泡产生,说明加入的硫酸是过量的,如果没有气泡产生,说明硫酸没有过量
.
(2)步骤④中,所加入的金属X与Zn的活动性顺序是Zn>X,金属X具有广泛用途,X是
Fe
Fe
,有关反应的化学方程式
CuSO4+Fe═Cu+FeSO4
CuSO4+Fe═Cu+FeSO4
.
(3)除去不纯铜中的杂质金属X,可选用的试剂或用品有
abd
abd
(填标号).
a.磁铁 b.稀盐酸 c.蒸馏水 d.氯化铜溶液.
(4)将分离出的SO
2通过下列碘循环工艺过程既能制H
2SO
4,又能制取H
2,其流程如下:
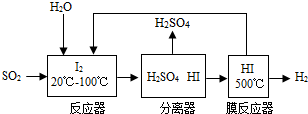
试写出反应器、膜反应器中的化学反应方程式
SO2+2H2O+I2═H2SO4+2HI
SO2+2H2O+I2═H2SO4+2HI
、
.




