
【题目】黄铁矿(主要成分为FeS2 ,杂质不含硫元素)是我国大多数硫酸厂制取硫酸的主要原料。化学课外活动小组为测定某黄铁矿中FeS2含量,进行了如下的实验探究(假设每步反应均完全),
[查阅资料]
①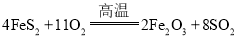
②![]()
[实验探究]
I .称取1.60 g黄铁矿样品放入如图①所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。
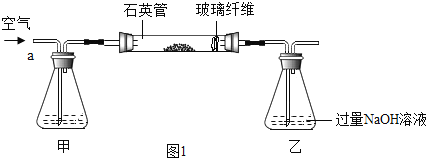
II.反应结束后,将乙瓶中的溶液进行如图②处理。
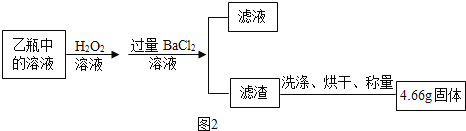
[问题讨论]
(1)I装置中甲瓶内盛放的试剂是氢氧化钠溶液,其作用是_____。
[含量测定]
(2)II中最终得到的4.66 g固体是_____(填物质的化学式);
(3)该黄铁矿中FeS2 的质量分数_____。
[交流反思]
(4)如果缺少甲装置,则最终测得FeS2的质量分数将会_____(填“偏大”“偏小”或“不变”);
(5) II中证明所加BaCl2溶液过量的方法是_____。
【答案】吸收空气中的二氧化碳 BaSO4 75% 偏大 取滤液少许于洁净的试管中,向其中滴加硫酸钠溶液,若有白色沉淀生成,则氯化钡溶液过量(合理即可)
【解析】
(1)由于空气中的二氧化碳能与氢氧化钠反应影响二氧化硫的测定,所以,I装置中甲瓶内盛放的试剂是氢氧化钠溶液,其作用是吸收空气中的二氧化碳。故答案为:吸收空气中的二氧化碳;
(2)乙瓶中盛放的是氢氧化钠和二氧化硫反应生成的亚硫酸钠。亚硫酸钠和氯化钡反应生成氯化钠和亚硫酸钡。由于过氧化氢具有强氧化性,能将亚硫酸钡氧化成硫酸钡,所以II中最终得到的4.66 g固体是BaSO4。故答案为:BaSO4;
(3)由于在化学变化中硫元素质量守恒,所以硫酸钡中硫元素的质量为:![]() ,则可以推测出FeS2的质量为:
,则可以推测出FeS2的质量为:![]() 。所以黄铁矿中FeS2的质量分数为:
。所以黄铁矿中FeS2的质量分数为: ![]() 。故答案为:75%;
。故答案为:75%;
(4)甲装置的作用是吸收空气中的二氧化碳。如果缺少甲装置,由于二氧化碳能与氢氧化钠反应,则导致乙中溶液的质量增重,从而导致最终测得FeS2 的质量分数将会偏大。故答案为:偏大;
(5)由于硫酸钠能与氯化钡反应生成氯化钠和硫酸钡沉淀。所以,II中证明所加BaCl2 溶液过量的方法是:取滤液少许于洁净的试管中,向其中滴加硫酸钠溶液,若有白色沉淀生成,则氯化钡溶液过量。故答案为:取滤液少许于洁净的试管中,向其中滴加硫酸钠溶液,若有白色沉淀生成,则氯化钡溶液过量(合理即可)。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:初中化学 来源: 题型:
【题目】为实现废物“资源化”利用的目的,以电石渣[主要成份为Ca(OH)2和CaCO3.其中Ca(OH)2为微溶物]为原料制备KClO3,其主要流程如图所示:

(1)氯化过程中,Cl2与Ca(OH)2作用,发生了一系列变化,最终生成Ca(ClO3)2和CaCl2,该反应的化学方程式中这两种生成物的化学计量数比为1:5
①生成Ca(CIO3)2的化学方程式______。
②提高Cl2转化为Ca(ClO2)2的转化率的可行措施有______(填标号)。
A 适当减缓通入Cl2速率 B 充分搅拌浆料 C 加水使Ca(OH)2完全溶解
(2)活性炭的作用是______;步骤甲的操作名称为______;残渣A中一定含有______。
(3)向步骤I得到的溶液中加入稍过量KCl固体可将Ca(ClO2)2转化为KClO3,该反应的基本反应类型为______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示的是物质A~G相互间的关系(“→”表示物质间存在的转化关系,“-”表示两端的物质能发生化学反应)A、F都是单质;F是使用最多的金属材料;B是导致温室效应的主要气体;在工业上,C广泛用于玻璃、造纸、纺织和洗涤剂的生产等;D的一种俗名为消石灰;E是一种蓝色溶液。请回答:
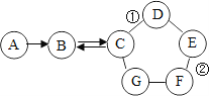
(1)C的化学式______,G可能是______(写名称)。
(2)写出D的一种重要用途______。(合理即可)
(3)写出标号①、②的化学反应方程式①______②______,反应的类型属于______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙是三种单质,其中乙是气体,丙是常见的黑色固体,A、B、C是三种化合物,它们之间有下列转化关系:
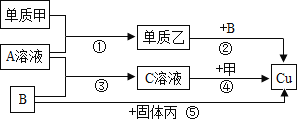
(1)用化学式表示下列物质:B______ 乙______丙______。
(2)写出⑤反应的化学方程式:______;
(3)①至⑤的反应中属于复分解反应的是______(填序号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】比较、分析、归纳是学习化学的有效方法。现有反应如下:
①![]()
②![]()
③![]()
④![]()
(1)通过比较、分析,可以发现上述四个反应有相似之处,均属于四种基本反应类型中的_____反应;
(2)分析反应①和②,可以得到:Zn、Cu、Ag这三种金属的活动性由强到弱的顺序是_____,用相似的思维方法类推到反应③和④中,我们还可以得到Cl2、Br2、I2三种非金属的活泼性强弱是_____,请写出氯气与碘化钾反应的化学方程式_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
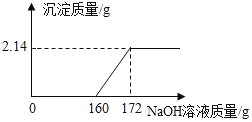
【题目】工业盐酸中通常溶有少量的FeCl3而呈黄色,小红为测定某工业盐酸中HCl的含量进行如下实验:取某工业盐酸l00g,滴加一定溶质质量分数的NaOH溶液,测得加入NaOH溶液质量与反应生成的沉淀质量关系如图所示。请回答下列问题:
(1)FeCl3与NaOH恰好完全反应时,生成沉淀的质量是______g。
(2)该工业盐酸中HCl的质量分数是多少(写出计算过程)______________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我市某地石灰石资源丰富,化学兴趣小组的同学为了测定该石灰石中碳酸钙的质量分数,用托盘天平称取了5份石灰石样品,分别加入各盛有200.0克稀盐酸的烧杯中充分反应(假设杂质不反应),得如下实验数据:
实验编号 | 1 | 2 | 3 | 4 | 5 |
石灰石样品的质量/g | 12.5 | 25.0 | 37.5 | 50.0 | 62.5 |
生成CO2的质量/g | 4.4 | 7.5 | 13.2 | 17.6 | 17.6 |
分析上述实验数据并回答:
(1)实验编号为_______的实验数据有明显错误。
(2)这种石灰石样品中碳酸钙的质量分数为__________。
(3)求稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“侯氏制碱法”制得的纯碱中含有少量氯化钠。为了测得该纯碱的组成,进行以下实验:取NaCl和Na2CO3的固体混合物25克溶于适量的蒸馏水中,逐滴滴入溶质质量分数为10%的稀盐酸。回答下列问题:
(1)NaCl在生活中的用途广泛,请写出一种用途:_____。
(2)当滴加稀盐酸至图中B点时,烧杯中溶液里的溶质是_____(填化学式)。
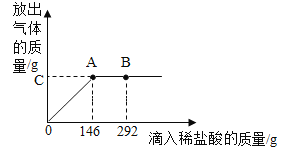
(3)求:原固体混合物中NaCl的质量分数_____(写出计算过程)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学中有许多概念是相对的,又是统一的。如图反映了饱和溶液、不饱和溶液、浓溶液以及稀溶液的关系。
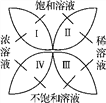
(1)从图中可以看出,饱和溶液与浓溶液、稀溶液的关系是________________________________;
(2)已知20 ℃时,100 g水中溶解36.0 g食盐正好达到饱和,现将0.9 g食盐放入100 g水中所得溶液可归入图中________(填“Ⅰ”“Ⅱ”“Ⅲ”或“Ⅳ”)区域;现有已接近饱和的食盐溶液,若要使它变为饱和溶液,一般采用的方法是____________________________或________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com