
【题目】为实现废物“资源化”利用的目的,以电石渣[主要成份为Ca(OH)2和CaCO3.其中Ca(OH)2为微溶物]为原料制备KClO3,其主要流程如图所示:

(1)氯化过程中,Cl2与Ca(OH)2作用,发生了一系列变化,最终生成Ca(ClO3)2和CaCl2,该反应的化学方程式中这两种生成物的化学计量数比为1:5
①生成Ca(CIO3)2的化学方程式______。
②提高Cl2转化为Ca(ClO2)2的转化率的可行措施有______(填标号)。
A 适当减缓通入Cl2速率 B 充分搅拌浆料 C 加水使Ca(OH)2完全溶解
(2)活性炭的作用是______;步骤甲的操作名称为______;残渣A中一定含有______。
(3)向步骤I得到的溶液中加入稍过量KCl固体可将Ca(ClO2)2转化为KClO3,该反应的基本反应类型为______。
【答案】6Cl2+6Ca(OH)2=5Ca(ClO3)2+CaCl2+6H2O AB 吸附有毒气体 过滤 活性炭 复分解反应
【解析】
(1)①根据信息“氯化过程中,Cl2与Ca(OH)2作用,发生了一系列变化,最终生成Ca(ClO3)2和CaCl2,该反应的化学方程式中这两种生成物的化学计量数比为1:5“和质量守恒定律可得,对应的化学生成 Ca(ClO3)2的化学方程式6Cl2+6Ca(OH)2=5Ca(ClO3)2+CaCl2+6H2O。
②A、适当减缓通入Cl2速率,能够使反应物之间接触时间长,提高转化率,符合题意;
B、充分搅拌浆料,能使反应物之间接触充分,提高转化率,符合题意;
C、加水使Ca(OH)2完全溶解,导致接触面积降低,降低了转化率,不符合题意。故选AB。
(2)活性炭的作用是吸附有毒气体氯气;步骤甲为将固液分离,操作名称为过滤;残渣A中一定含有活性炭。
(3)向步骤I得到的溶液中加入稍过量KCl固体可将Ca(ClO2)2转化为KClO3,是KCl和Ca(ClO2)2转化为KClO3,和氯化钙,为两种化合物相互交换成分生成两种新的化合物,符合复分解反应特征,属于复分解反应。


科目:初中化学 来源: 题型:
【题目】下图是A、B二种固体物质的溶解度曲线图,请回答:
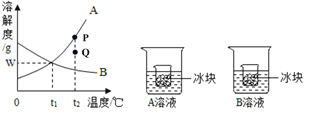
(1)在t2℃时,P点对应的是A物质的_____溶液(填“饱和”或“不饱和”)。
(2)欲使A溶液的状态从P点转化为Q点,可采取的措施是_____。
(3)t1℃时,将A、B各Wg分别加入到两只盛有100g水的烧杯中,充分搅拌得到A溶液和B溶液,然后分别放入盛有同样冰块的小烧杯。一段时间后,B溶液的质量分数_____(填“变大”、“变小”或“不变”)。若W的值为20,则A、B在t1℃的质量分数是_____(计算结果保留到小数点后一位)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科,请结合下列图示实验装置,回答问题。
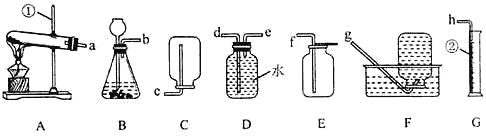
(1)图中①、②仪器的名称是:①___________;②___________。
(2)用氯酸钾和二氧化锰固体制取较纯的氧气时,可选用的发生装置和收集装置是___________(填字母序号),反应的化学方程式是___________。
(3)小阳欲制取并测定生成氢气的体积,请从上图A~G中选择最佳的装置进行组合,整套装置的导管口连接顺序是b→___________(填接口序号)。
(4)小李用锥形瓶收集一瓶二氧化碳气体,并利用下图所示的装置做趣味实验,他将胶头滴管中氢氧化钠溶液挤压到锥形瓶后,可以观察到的现象为___________,其原因是___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两物质的溶解度曲线如图所示。下列叙述中,正确的是( )
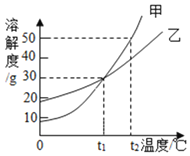
A. 甲溶解度一定大于乙溶解度
B. ![]() 时,甲和乙的饱和溶液中溶质质量分数相等
时,甲和乙的饱和溶液中溶质质量分数相等
C. ![]() 时,在100g水中放入60g甲,其溶质的质量分数为
时,在100g水中放入60g甲,其溶质的质量分数为![]()
D. ![]() 时,分别在100g水中各溶解20g甲、乙,同时降低温度,甲先达到饱和
时,分别在100g水中各溶解20g甲、乙,同时降低温度,甲先达到饱和
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】草甘膦( C3H8NO5P)是全球使用最广泛的除草剂之一,具有酸性。下列说法正确的是( )
A. 草甘膦由18个原子构成B. 氢、氧元素的质量比为8:5
C. 草甘膦溶液可长期贮存在铁质容器中D. 该物质中氧元素的质量分数最大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面的科普材料。
在人类社会的发展过程中,金属起着重要的作用。从五千年前使用的青铜器,三千年前进入铁器时代,直到20世纪铝合金成为仅次于铁的金属材料,金属材料对于促进生产发展、改善人类生活发挥了巨大的作用。
金属材料包括纯金属和它们的合金。合金具有许多优良的物理性质、化学或机械性能,在许多方面不同于各成分金属。例如:合金的硬度可以大于它的纯金属成分,熔点也可以低于它的成分金属。而且,使用不同的原料,或原料的配比不同,就可以得到具有不同性能的合金。
青铜是我国使用最早的合金。东汉铜奔马身高34.5厘米,身长45厘米,宽13厘米,重7.15千克。形象矫健俊美,别具风姿。充分体现了我国光辉灿烂的古代科技。除青铜外,常见的还有黄铜(含锌及少量的锡、铅、铝等)和白铜(含镍、锌及少量的锰)等合金。
除少数金属外,大多数金属在自然界中都是以化合物的形式存在。为了能够提供人类所需的金属材料,就需要将金属从矿石中冶炼出来。我国古代就发明了湿法炼铜的方法,就是用铁将铜从硫酸铜溶液中置换出来,我国是最早使用该方法的国家。
随着科技水平和冶炼工艺的不断提高,目前,常见的冶炼方法主要有以下几种:
冶炼方法 | 反应表示式(其他生成物略去) | 代表性金属 |
热还原法 | 金属A的氧化物+碳(或一氧化碳等) | 锌、铜 |
电解法 | 金属B的化合物 | 镁、铝 |
热分解法 | 金属C的氧化物 | 汞、银 |
工业上就是利用一氧化碳还有赤铁矿冶炼得到金属铁。
金属材料应用广泛。钛合金是一种性能非常优越的金属,它的化学性质稳定,耐腐蚀,尤其是抵抗海水腐蚀能力很强,目前广泛用于飞机、火箭、导弹、人造卫星和宇宙飞船等领域。
人类每年要从自然界提取数以亿吨计的金属的同时,大量的金属却因腐蚀而报废。每年因腐蚀而报废的金属设备和材料相当于年产量的20%﹣40%.防止金属的腐蚀已成为科学研究和技术领域中的重大问题。回答下列问题:

(1)金属可以做炊具,利用了金属的___性。
(2)赤铁矿石属于___(填“纯净物”“混合物”。)
(3)根据材料,写出工业用氯化镁冶炼镁的化学方程式___。
(4)为了防止金属腐蚀,可以在金属表面附着保护膜,其原理是___。
(5)下列方法,不能鉴别黄铜和纯铜的是___。
A 刻划法 B AgNO3溶液 C HCl D NaNO3溶液
(6)现将一定量的Zn、Fe 投入到含有Cu(NO3)2和AgNO3的混合溶液中,充分反应后,过滤得到滤渣和滤液。向滤渣中加入稀硫酸,无明显现象,则溶液中可能有的物质是(写化学式)___。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某工厂废水中含碳酸钠(易溶于水),造成水体污染。化学兴趣小组设计废水处理和利用的方案,进行了如下实验:取过滤后的水样200g,逐滴加入稀盐酸至恰好不再产生气体为止,反应过程中生成气体与所加稀盐酸的质量关系如图所示。请回答下列问题(碳酸钠与盐酸反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,不考虑水样中杂质的影响):
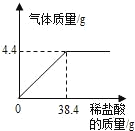
(1)反应生成CO2气体的质量是_____g;
(2)求废水中碳酸钠的质量分数。____(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图为实验室制取气体的常见装置。请回答

(1)写出装置A制取氧气的化学方程式_____.
(2)收集一瓶氧气用于完成铁丝在氧气中燃烧的实验最好用 _____(填序号)装置。
(3)写出实验室制取二氧化碳的化学反应方程式______.
(4)若用F装置干燥二氧化碳,瓶中应装_______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com