
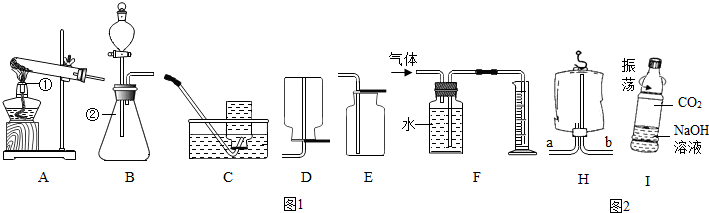
 2H2O+O2↑;
2H2O+O2↑; 2H2O+O2↑;从分液漏斗流下的双氧水占有一定的体积;(4)b;(5)将氢氧化钠溶液溶液换成等体积的蒸馏水作对比试验;CO2+2NaOH=Na2CO3+H2O.
2H2O+O2↑;从分液漏斗流下的双氧水占有一定的体积;(4)b;(5)将氢氧化钠溶液溶液换成等体积的蒸馏水作对比试验;CO2+2NaOH=Na2CO3+H2O.

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:初中化学 来源: 题型:
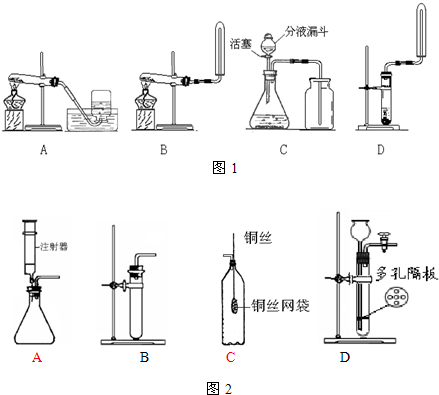
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 大部分 |
| 小部分 |
| NaOH溶解放热 |
| NaOH溶解放热 |
| H2SO4 |
| △ |
查看答案和解析>>
科目:初中化学 来源: 题型:
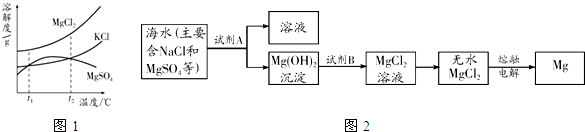
查看答案和解析>>
科目:初中化学 来源:2011-2012学年福建省福州市福清市元樵中学九年级(上)期末化学练习试卷(解析版) 题型:解答题
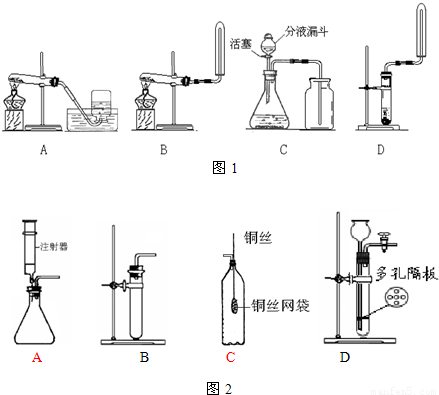
查看答案和解析>>
科目:初中化学 来源:2006年江苏省苏州中学国际班提前招生化学试卷(解析版) 题型:填空题
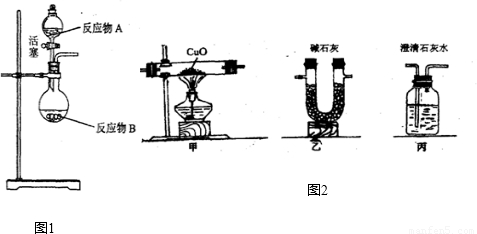
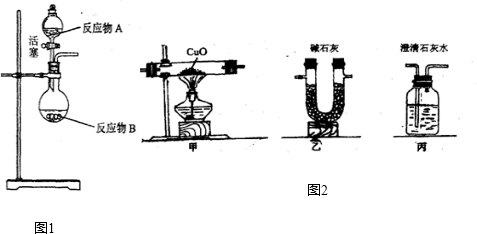
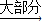 NH3?H2O
NH3?H2O NH4++OH-,氨水中主要溶质微粒是NH3?H2O,NH3?H2O不稳定,受热条件下易分解放出氨气.另外,上述反应可逆反应(即在相同条件下能同时向左右两个方向进行的反应),增加反应物的浓度,能促使反应向右进行,增加产物的浓度,能促使反应向左进行.某同学用浓氨水和另一种固体物质制取氨气,反应物A为浓氨水,反应物B为 固体,用该方法制取氨气的原理为 (用文字表述).
NH4++OH-,氨水中主要溶质微粒是NH3?H2O,NH3?H2O不稳定,受热条件下易分解放出氨气.另外,上述反应可逆反应(即在相同条件下能同时向左右两个方向进行的反应),增加反应物的浓度,能促使反应向右进行,增加产物的浓度,能促使反应向左进行.某同学用浓氨水和另一种固体物质制取氨气,反应物A为浓氨水,反应物B为 固体,用该方法制取氨气的原理为 (用文字表述).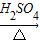 CO2↑+CO↑+H2O.若用图2所示的发生装置进行实验,还需要添加的仪器有酒精灯、铁圈和 .某同学为检验混合气体中的CO,将所得混合气体依次通过乙、丙、甲、丙,尾气点燃,其中第一次通过丙的作用是 .
CO2↑+CO↑+H2O.若用图2所示的发生装置进行实验,还需要添加的仪器有酒精灯、铁圈和 .某同学为检验混合气体中的CO,将所得混合气体依次通过乙、丙、甲、丙,尾气点燃,其中第一次通过丙的作用是 .查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com