
����Ŀ����ʽ̼��þ[Mg2(OH)2CO3]������þ(MgO2)������Ҫ����ԭ�ϡ�
�� ��Mg2(OH)2CO3Ϊԭ�ϣ��Ʊ���ƷMgO2�IJ������£�
��1������ ����Mg2(OH)2CO3�õ��������������һ�ֳ����������壬����ʹ����ʯ��ˮ����ǡ�����ʱ��Ӧ�Ļ�ѧ����ʽΪ ��
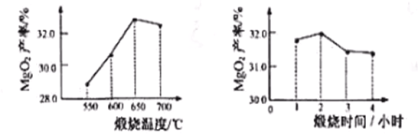
��2��ת�� �����ù����м�˫��ˮ��ֽ��裬������ӦMgO+H2O2=MgO2+H2O���¶����ߣ�˵���÷�Ӧ ����(��ų��������ա�)������������ͬ�������¶ȡ�����ʱ�䲻ͬ������MgO��MgO2����(����=![]() ��100%)��Ӱ��ֱ���ͼ��ʾ������ѵ������¶�Ϊ ��������ʱ��Ϊ Сʱ��
��100%)��Ӱ��ֱ���ͼ��ʾ������ѵ������¶�Ϊ ��������ʱ��Ϊ Сʱ��
��3������ �õ���Ʒ
��4���ⶨ �����Ʒ�н���������MnO��ijС���������װ�ã�ͨ���ⶨ����O2�����������MgO2������������
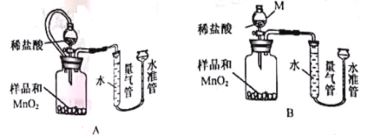
��֪��A��MnO2��ϡ�����Ӧ B��MgO2+2HCl=MgCl2+H2O2
C��2MgO2![]() 2MnO+O2�� D��MgO+C
2MnO+O2�� D��MgO+C![]() Mg+CO��
Mg+CO��
������M�������� ��MnO2�������� ��
����ͬ�����£� ��ʹ�ⶨ�����ȷ��(�װ��A����װ��B��)
��ʵ������������������Ϊ37%���ܶ���1.18g��mL-1��Ũ��������10%��ϡ����110g����Ҫˮ mL��(ˮ���ܶ���1g��mL-1������������һλС��)
�������ۣ���С�������������3�ַ������ֱ�ȡ5.0g��Ʒ����ʵ�飬��ȷ��MgO2������������ ��(�����)
A�����ȣ�ʹMgO2��ȫ�ֽ⣬���ʣ����������
B��������̿���ڸ����³�ַ�Ӧ���������Mg������
C���ȼ�����ϡ���ᣬ�ټ�����NaOH��Һ����ַ�Ӧ�����Mg(OH)2����
�� MgCl2���Ʊ�Mg2(OH)2CO3��ԭ�ϡ����ú�̼��þ84%����þ���Ʊ�MgCl2����Ӧ���£�
MgCO3+Cl2+CO![]() MgCl2+2CO2(�����ʲ��μӷ�Ӧ)������19��MgCl2��Ҫ��������þ����ٶ֣�(д���������)
MgCl2+2CO2(�����ʲ��μӷ�Ӧ)������19��MgCl2��Ҫ��������þ����ٶ֣�(д���������)
���𰸡���1�� Mg2(OH)2CO3![]() 2MgO+CO2��+H2O�� ��2���ų� 650 2 ��4������Һ©�� �� ��A ��80.3 ��a �� 16.8t
2MgO+CO2��+H2O�� ��2���ų� 650 2 ��4������Һ©�� �� ��A ��80.3 ��a �� 16.8t
����������1�� ����Mg2(OH)2CO3�õ��������������һ�ֳ����������壬����ʹ����ʯ��ˮ����ǡ�����ʱ��Ӧ�Ļ�ѧ����ʽΪMg2(OH)2CO3![]() 2MgO+CO2��+H2O����2�� �����ù����м�˫��ˮ��ֽ��裬������ӦMgO+H2O2=MgO2+H2O���¶����ߣ�˵���÷�Ӧ�ų���������������ͼ��֪��ѵ������¶�Ϊ650��������ʱ��Ϊ2Сʱ����4���ⶨ������M�������Ƿ�Һ©����MnO2�������Ǵ����ã�����ͬ�����£�Aװ����ʹ�ⶨ�����ȷ����ΪAװ������ƽ����ѹ��װ�ã���ʵ������������������Ϊ37%���ܶ���1.18g��mL-1��Ũ��������10%��ϡ����110g����Ҫˮ������ Ϊ;110g-(10%��110g)/37%=80.3g;���ֱ�ȡ5.0g��Ʒ����ʵ�飬��ȷ��MgO2������������A�����ȣ�ʹMgO2��ȫ�ֽ⣬���ʣ����������;������19��MgCl2��Ҫ��������þ��Ϊx
2MgO+CO2��+H2O����2�� �����ù����м�˫��ˮ��ֽ��裬������ӦMgO+H2O2=MgO2+H2O���¶����ߣ�˵���÷�Ӧ�ų���������������ͼ��֪��ѵ������¶�Ϊ650��������ʱ��Ϊ2Сʱ����4���ⶨ������M�������Ƿ�Һ©����MnO2�������Ǵ����ã�����ͬ�����£�Aװ����ʹ�ⶨ�����ȷ����ΪAװ������ƽ����ѹ��װ�ã���ʵ������������������Ϊ37%���ܶ���1.18g��mL-1��Ũ��������10%��ϡ����110g����Ҫˮ������ Ϊ;110g-(10%��110g)/37%=80.3g;���ֱ�ȡ5.0g��Ʒ����ʵ�飬��ȷ��MgO2������������A�����ȣ�ʹMgO2��ȫ�ֽ⣬���ʣ����������;������19��MgCl2��Ҫ��������þ��Ϊx
MgCO3+Cl2+CO![]() MgCl2+2CO2
MgCl2+2CO2
84 95
X 19t
84/x=95/19t
t=16.8t
������19��MgCl2��Ҫ��������þ��16.8t


 ������ʱͬ����ϰ��ϵ�д�
������ʱͬ����ϰ��ϵ�д� ѧҵ����һ��һ��ϵ�д�
ѧҵ����һ��һ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�м������dz��л�ѧ�̲��г������ʡ��ס���Ϊ�������Ҽ�Ϊ��ɫ���壬�ҡ����ֱ���������е�һ�֣����Ǵ���ʯ����Ҫ�ɷ֡���ͼ��������ʾ���������ʼ�ɷ�����Ӧ����������ʾһ�����ʿ�ת��Ϊ��һ�����ʣ���Ӧ���������ַ�Ӧ���������������ȥ��������˵���в���ȷ����
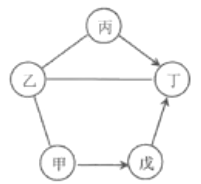
A������Һ��ʹ��ɫʯ����Һ��� B������Һ�����췴Ӧ���ɶ�
C��������ֻ��ͨ���û���Ӧʵ�� D�������ɼ�ͨ��һ����Ӧ���ɶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��ͨ��̽���ѧϰ�����⻯ѧ֪ʶ������һ���о�ѧϰ�����ش��й����⣮
�о����⣺ˮ��Һ�и��ֽⷴӦ��ʵ��
�����Ϣ��һ���������Һ�У����ӵ���ĿԽ�࣬�����ӵ�Ũ��Խ�絼�ʴ��������ڲ�����Һ�ĵ�����ǿ�����ܷ�ӳ����Ũ�ȴ�С����ͬ�¶���ͬ����Һ�絼��Խ������Ũ��Խ��
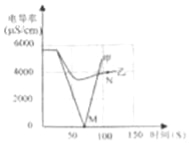
��1��ʵ��һ�����������£���һ�����һ��Ũ�ȵ�ϡBa��OH��2��Һ�еμ�2��3����ɫ��̪��Һ������絼�ʴ�������Ȼ��μ�ϡ���ᣬ�����Һ�ĵ絼�ʱ仯��ͼ�м�������ʾ��
��д��Ba��OH��2��H2SO4��Ӧ�Ļ�ѧ����ʽ ��
��������M��ʱ���Һ��� ɫ��
��ͨ���Լ����ߵķ���������˵��������� ������ţ���
A��M��ǰ�����»��Ĺ����У�H+��OH����ϳ�H2O��Ba2+��SO42����ϳ�BaSO4
B��M��ʱ����Ũ�ȼ���Ϊ�� C��M�����Һ�絼��������������Һ��H+��������
��2��ʵ��������������£������ͬŨ�ȵ�ϡBa��OH��2��Һ�еμ�2��3����ɫ��̪��Һ������絼�ʴ�������Ȼ��μ�ϡNa2SO4��Һ�������Һ�ĵ絼�ʱ仯����ͼ��������ʾ��
��ͨ���������ߵķ���������˵��������� ������ţ���
A����ʼ����ȫ��Ӧ�����У��絼�ʼ�С����Һ�ɺ�ɫ��Ϊ��ɫ
B���絼���½�����͵�ʱ��Ȼ�ϴ�����Һ�л����ڽ϶�����
C������ʵ������У���Һ��Na+��Ŀһֱ����
��N��ʱ����Һ�к��е������� �������ӷ��ţ���
��ͨ���ȽϷ����������ѧ֪ʶ��֪����Һ�и��ֽⷴӦ��ʵ���Dz��뷴Ӧ�����ӣ���������˳����������ˮ��������Ũ�� �������С������
��3����չ���������ʾ����д���ӷ���ʽ��
ʾ��AgNO3+NaCl=AgCl��+NaNO3���ӷ���ʽ��Ag++Cl��=AgCl��
��д��BaCl2+Na2SO4=BaSO4��+2NaCl���ӷ���ʽ�� ��
����һ�������ͳ���ʯ��ˮ�г���ͨ�������CO2���壬��Һ�ȱ���Ǻ��������ʧ�����Ʋ�˹��̵���Һ��Ca2+��Ũ�ȱ仯��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ�ס������ֹ�������(�����ǽᾧˮ) ���ܽ�����ߡ�����˵���������
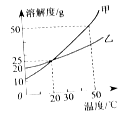
A��20 ��ʱ���ס��Ҿ�����ͬ���ܽ��
B���ס��ҵ��ܽ�ȶ����¶ȵ����߶�����
C��20 ��ʱ�������������ʵ���������Ϊ25%�ļ���Һ
D��50��ʱ�����Ҹ�30g�ֱ����100gˮ�У�����ܽ��ͬʱ���ٽ��£�������Һ�����й������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ӧǰ����ӱ仯����ʾ��ͼ���¡�����˵����ȷ����
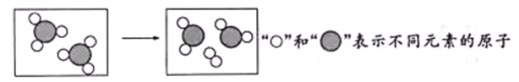
A����Ӧ���������ﹲ��3������ B����Ӧ��ԭ�Ӹ�������
C����ͼ��ʾ��CO��O2�ķ�Ӧ D����Ӧ����Ԫ�صĻ��ϼ۶�Ϊ0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й���Һ˵����ȷ����
A����Һ���Ǿ�һ���ȶ��Ļ���� B���γ���Һ�����ʶ��ǹ���
C�����б�����Һ���Ȳ�������ҺҪŨ D����Һ������������ʵ�������ܼ������֮��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1g��������n��N2���ӣ���ӵ������ɱ�ʾΪ
A��(1/14)n B��(1/28)n C��14n D��28n
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������з������Ƶ���Һ����������������Ϊ5������
A����ȡ5.0g�����أ��ܽ���95mLˮ�У���ֽ���
B����ȡ5.0g��ʯ�ң�����95mLˮ�У���ֽ���
C����ȡ5.OmLŨ���ᣬ����95mLˮ�У���ֽ���
D����ȡ5.0g�������̣�����95mLˮ�У���ֽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������װ��ͼ���ش��й����⣺
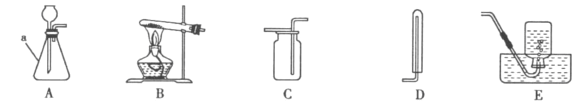
��l��д��ͼ�б��Ϊa����������_______��
��2��ʵ�������������ȡ��������ѧ����ʽΪ_______���÷�Ӧ�Ļ�����Ӧ������_______��ֹͣ����ʱӦ�Ƚ������Ƴ�ˮ�棬��������_______��
��3����Cװ���ռ������������ķ�����_______��
��4��ʵ������ȡCO2Ӧѡ��ķ������ռ�װ����_______������ĸ��ţ���
��5����Aװ��������ʱ������©�����¶˹ܿ�Ҫ_______���Է�ֹ���ɵ������ݳ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com