
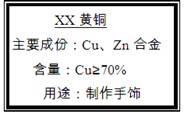
(10分)小强买来一包黄铜(铜、锌合金),包装说明如右图,他对包装说明上的质量分数产生了疑问,他称取20g黄铜样品放入烧杯中,然后往烧杯中加入稀硫酸93.7g,恰好完全反应,反应后称得烧杯内物质共113.5g。
(1)反应产生氢气 g。
(2)通过计算判断该黄铜样品中铜的质量分数是否与包装说明相符(计算结果精确到0.1%,下同)。
(3)计算反应后所得溶液中溶质的质量分数是多少?
(1) 0.2 (2)因为67.5%<70%,所以与包装说明不相符 (3)16.1%
【解析】试题分析:1、由于黄铜中只有锌与稀硫酸反应放出氢气,因此反应前后烧杯内物质总质量减小的部分即为产生氢气的质量,因此反应产生的氢气质量为:20+93.7-113.5=0.2克;
2、要计算黄铜的质量分数,先得计算出铜的质量。我们先可以根据氢气的质量计算出锌的质量,再用黄铜总质量减去锌的质量,即可得出铜的质量。而第(3)小题中要计算的溶质质量分数,就是反应生成的硫酸锌的质量分数,可以根据化学方程式计算硫酸锌的质量,再用硫酸锌的质量除以总溶液的质量即可。
解:设Zn质量为x, ZnSO4质量为y
Zn +H 2SO4 = ZnSO4 + H2↑ …………1分
65 161 2
x y 0.2g …………1分
 …………1分
…………1分
x=6.5g y=16.1g …………1分
该黄铜样品中Cu质量分数=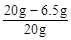 ×100%=67.5% …………1分
×100%=67.5% …………1分
因为67.5%<70%,所以与包装说明不相符 …………1分
反应后溶质质量分数=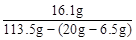 ×100%=16.1% …………2分
×100%=16.1% …………2分
答:略
考点:质量守恒定律及其应用;有关溶质质量分数的简单计算;根据化学反应方程式计算。
点评:本题解题关键在于找出氢气的质量。


科目:初中化学 来源:2010届广东省汕头市龙湖区中考模拟化学试卷(带解析) 题型:计算题
(10分)小强买来一包黄铜(铜、锌合金),包装说明如右图,他对包装说明上的质量分数产生了疑问,他称取20g黄铜样品放入烧杯中,然后往烧杯中加入稀硫酸93.7g,恰好完全反应,反应后称得烧杯内物质共113.5g。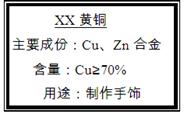
(1)反应产生氢气 g。
(2)通过计算判断该黄铜样品中铜的质量分数是否与包装说明相符(计算结果精确到0.1%,下同)。
(3)计算反应后所得溶液中溶质的质量分数是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com