
【题目】有一包固体粉末,可能含碳、铝、铜、氧化铝、氧化铜中的一种或几种。为探究该固体粉末的组成,某化学兴趣小组进行了如下图所示实验:

(1)向样品中加入过量稀盐酸产生的气体是_________。
(2)向固体A中加入硝酸银溶液,发生反应的化学方程式为__________。
(3)固体B中含有的物质是__________。
(4)原固体样品中一定含有的物质是__________。
(5)蓝色溶液丙中一定含有的溶质是_________。
【答案】 氢气(H2) Cu+2AgNO3=2Ag+Cu(NO3)2 碳、银(或C、Ag) 碳、铝、铜(或C、A1、Cu) 硝酸铝、硝酸铜和硝酸(或Al(NO3)3、Cu(NO3)2、HNO3)
【解析】(1)根据铝与盐酸反应生成氢气解答;(2)根据铜与硝酸银反应生成银和硝酸铜解答;(3)根据铜与硝酸银反应及固体B在氧气中充分灼烧,生成能使澄清石灰水变浑浊的气体解答;(4)(5)根据图中信息分析解答。(1)向样品中加入过量稀盐酸有气体生成,根据金属活动性顺序可知,是铝与盐酸反应,生成的气体是氢气;(2)固体A与硝酸银反应有蓝色溶液生成,说明固体A中含有铜,铜与硝酸银反应生成银和硝酸铜,反应的化学方程式为Cu+2AgNO3=2Ag+Cu(NO3)2;(3)铜与硝酸银反应生成银;固体B在氧气中充分灼烧,生成能使澄清石灰水变浑浊的气体,该气体是二氧化碳。灼烧能生成二氧化碳气体的物质是碳,故固体B中含有的物质是碳、银(或C、Ag);(4)样品中加过量稀盐酸有气体产生,说明原固体中有铝;将反应后的固液混合物过滤,得到无色溶液甲(说明原固体中没有氧化铜)和固体A,固体A加一定量的硝酸银溶液并过滤,得到蓝色溶液乙(说明原固体中有铜)和固体B;固体B在氧气中充分灼烧,生成能使澄清石灰水变浑浊的二氧化碳气体(说明原固体有碳)。故原固体样品中一定含有的物质是碳、铝、铜(或C、A1、Cu) ;(5)无色溶液甲与蓝色溶液乙反应生成白色固体,说明蓝色溶液乙中含有硝酸银,无色溶液甲中溶质是盐酸及盐酸与铝反应生成的氯化铝。盐酸与硝酸银反应生成氯化银和硝酸,氯化铝与硝酸银反应生成氯化银和硝酸铝,蓝色溶液乙中的溶质硝酸铜不参与反应。故蓝色溶液丙中一定含有的溶质是硝酸铝、硝酸铜和硝酸(或Al(NO3)3、Cu(NO3)2、 HNO3)。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:初中化学 来源: 题型:
【题目】某纯碱厂生产的某批次碳酸钠产品中可能含有氯化钠杂质。
定性检验
(1)要确定该产品中是否含有杂质氯化钠,你的方法是_________________。
定量测定:
(2)若利用沉淀法测定该产品中碳酸钠的质量分数,你确定的反应原理是(用化学方程式表示)_______________________________。
(3)假设你取样的质量为m1,根据你确定的反应原理,你需要通过实验测量沉淀(填化学式)____的质量(假设你测得的沉淀的质量为m2)。
(4)请你设计实验方案,获得数据m1、m2,把方案填在下表中。
适用的仪器名称 | 实验步骤 |
____________ | ______ |
(5)数据处理:
请用含m1、m2的式子表示所测样品中碳酸钠的质量分数,______________________。
分析讨论:
(6)要测定混合物中某成分的含量,可通过化学方法将不易测定的物质转化为易测量的物质。除沉淀法外,还可依据反应(用化学方程式表示)_______________来测定该纯碱样品中碳酸钠的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列实验操作容器中都有水,其解释没有体现水的主要作用的是( )
A | B | C | D | |
实验 装置 |
硫在O2中燃烧 |
测定空气中O2含量 |
铁丝在O2中燃烧 |
探究燃烧条件 |
解释 | 集气瓶中的水:吸收放出的热量 | 量筒中的水:通过水体积的变化得出O2的体积 | 集气瓶中的水:冷却溅落融化物,防止集气瓶炸裂 | 烧杯中的水:加热铜片,隔绝空气 |
A. A B. B C. C D. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学反应的实质是构成物质分子的原子重新进行组合,形成新分子的过程。如图是在密团容器中某化学反应过程的微观示意图。据图回答:

(1)参加反应的“![]() ”与“
”与“![]() ”的分子个数比为_________。
”的分子个数比为_________。
(2)该反应的基本反应类型是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组用下图所示的装置来制取干燥的氧气,并测定H2O2溶液中溶质的质量分数。装置气密性良好,图中的锥形瓶内盛有质量为m的H2O2溶液,燃烧匙内装有二氧化锰,燃烧匙可以上下移动,干燥管内装有足量碱石灰(CaO和NaOH的混合物)。下列说法正确的是
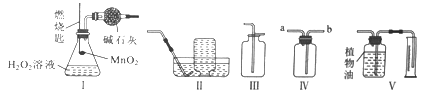
A. 将装置I分别与装置II、III、IV、V连接,均能达到实验目的
B. 称量装置I反应前及完全反应冷却后的质量,可计算出H2O2溶液中溶质的质量分数
C. 若用装置IV收集氧气,可将带火星的木条放置在b导管口处验满
D. 若用装置V测量生成氧气的体积,集气瓶上方原有的空气会使测量结果偏大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】海螵蛸是一味中药,其主要成分是碳酸钙,某同学利用如图装置测定其中碳酸钙的含量。
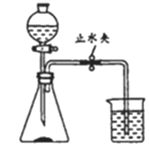
①在锥形瓶中加入质量为m的海螵蛸粉末,向分液漏斗中加入稀盐酸。在烧杯中加人足量氢氧化钠溶液,并称量烧杯及氢氧化钠溶液总质量m1
②先打开止水夹,再打开分液漏斗活塞,滴加盐酸并及时关闭活塞。完全反应后,再次称量烧杯及其中液体的总质量m2.
③利用m2与m1的差值,即反应生成的二氧化碳质量,再计算海螵蛸中碳酸钙的含量。
(1)海螵蛸具有治疗胃酸过多、能为骨质发育提供重要元素的功效,其原因是___________。
(2)实验前要检查装置的气密性,方法是:用止水夹夹住橡胶管,往分液漏斗中加入适量水。打开分液漏斗的活塞.观察到_______,说明装置气密性 良好。
(3)下列情况会导致海螵蛸中碳酸钙质量分数测量值偏小的是______(可多选)。
A.海螵蛸中滴加盐酸过量
B,锥形瓶内部分水蒸气随二氧化碳逸出
C.反应结束后,锥形瓶内有二氧化碳残留
D.反应速度过快,大量气泡从氢氧化钠溶液中溢出
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】酸、碱、盐在生产生活中具有广泛的用途。
(1)化学实验室有失去标签的稀硫酸、氢氧化钠、氢氧化钙、碳酸钠、氯化钡五瓶无色 溶液,现将其任意编号:A、B、C、D、E,然后两两组合进行实验,其部分现象如下表(微溶物视为可溶物):
实验 | A+B | A+C | A+D | B+C |
现象 | 产生气体 | 产生沉淀 | 产生沉淀 | 产生沉淀 |
①写出溶液 B、C 中溶质的化学式: B_____,C_____。
②写出溶液 A 与 D 反应的化学方程式_____。
(2)我国制碱工业先驱侯德榜发明了“侯氏制碱法”,其主要化学原理:
NaCl+H2O+NH3+CO2=NaHCO3↓+X; 2NaHCO3Na2CO3+H2O+CO2↑等;
回答下列问题:
①X 的化学式为_____。
②将碳酸钠和碳酸氢钠的混合物 l0g 充分加热至质量不再改变,冷却,称量剩余固体 质量为 6.9g,则原混合物中碳酸钠和碳酸氢钠的质量比为_____(写最简比)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验课上,同学们利用下列装置进行气体制备的学习。请回答下列问题:
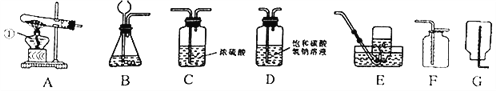
(1)编号①的仪器名称是_____。
(2)用加热法制取氧气,所选择的发生装置是_____ (填字母,下同),收集装置是_____,反应的化学方程式为_____。
(3)若要制取瓶纯净、干燥的二氧化碳气体 (常混有少量氯化氢气体和水蒸气,装置连接的正确顺序是:产生气体→_____→_____→F.检验二氧化碳气体的方法是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组在实验室里准备常见酸、碱、盐的性质实验时, 发现实验台上摆放的药品中,有一瓶未盖瓶塞且标签破损的溶液(如图), 他们决定对这瓶溶液的成分进行探究。
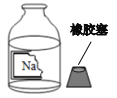
(提出问题)这瓶溶液的溶质是什么?
(获得信息)
(1)酸、碱、盐的性质实验中用到含钠元素的物质有氯化钠、氢氧化钠、碳酸钠、碳酸氢钠。
(2)实验室里盛放碱性溶液的试剂瓶通常使用橡胶塞。
(3)碳酸氢钠溶液与氯化钡溶液不反应;氯化钡溶液呈中性。
(提出猜想)猜想一:氢氧化钠; 猜想二:碳酸钠; 猜想三:碳酸氢钠。
(实验探究)
(1)小军取样滴加稀盐酸有_____产生,得出结论:该溶液的溶质是碳酸钠或者是_____。
(2)小军另取样加入过量的氯化钡溶液,观察到有_____产生,进而得出结论:该溶液的溶质是碳酸钠。
(3)小华认为小军的结论不完全正确,理由是_____。 小组同学讨论后一致认为还需要进行如下实验:
(4)取小军第二次实验后的上层清液,滴入无色酚酞试液,溶液呈红色。
(实验结论)这瓶溶液的原溶质是_____。
(探究启示)实验中取用液体药品时,应注意_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com