
【题目】根据下列的实验常用仪器回答有关问题。
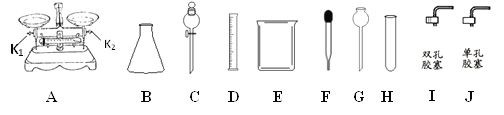
(1)仪器B的名称是__________,仪器G的名称是___________。
(2)现有一瓶溶质质量分数为35%的浓盐酸,将其稀释配制100g溶质质量分数为10%的稀盐酸,若不使用仪器A,查阅资料,必需知该浓盐酸有关________的数据,从而可以利用上述仪器中的D、E、玻璃棒和仪器_______(填序号)配制溶液。实验室制取CO2,装配一个是能够控制反应速率的发生装置,应选用上述仪器中的__________,其反应方程式为____________________________。
(3)用仪器A称量5g的NaCl固体,需要仪器A进行调平:游码归零,在两端的托盘分别放等质量的________,调节两端的平衡螺母,若天平往左端倾斜,应该将K2往_________(选填“左”或“右”,下同)调节。
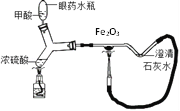
(4)某微型实验装置如图,甲酸与热的浓硫酸反应生成CO ,利用CO还原氧化铁,反应过程中氧化铁的颜色变化为______。 澄清石灰水处的现象是___________,该装置为微型实验装置,微型实验的优点是__________________。
【答案】 锥形瓶 长颈漏斗 密度 F BCI或CHI CaCO3 + 2HCl =CaCl2 +H2O +CO2↑ 称量纸或烧杯 右 由红色变成黑色 澄清石灰石变浑浊(或者变浑浊) 消耗药品少、所用仪器和操作简单、污染少、符合绿色化学理念(意思对即可)
【解析】本题考查了溶液的稀释,实验室制取二氧化碳的发生装置改进,炼铁原理装置的改进。
(1)仪器B的名称是锥形瓶,仪器G的名称是长颈漏斗;
(2)稀释配制100g溶质质量分数为10%的稀盐酸,需要知道浓盐酸的质量,不用天平称量,还可根据M=ρV,必需知该浓盐酸有关密度的数据,从而可以利用上述仪器中的D、E、玻璃棒和仪器F;实验室制取二氧化碳的反应物是固体和液体,反应条件是常温,分液漏斗能控制液体的滴加速率,能控制反应的速率,所以应选上述仪器中的BCI或CHI来组装发生装置;碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,反应方程式为CaCO3 + 2HCl =CaCl2 +H2O +CO2↑;
(3)用天平称量5g的NaCl固体,需要将天平进行调平:游码归零,在两端的托盘分别放等质量的称量纸或烧杯,调节两端的平衡螺母,若天平往左端倾斜,应该将K2往右调节;
(4)①一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,氧化铁的颜色变化是:由红色变成黑色;二氧化碳能使澄清的石灰水变浑浊,澄清石灰水处的现象是澄清石灰石变浑浊(或者变浑浊);微型实验的优点是消耗药品少、所用仪器和操作简单、污染少、符合绿色化学理念(意思对即可)。


科目:初中化学 来源: 题型:
【题目】过氧化镁(MgO2)是一种镁精细化工产品。在医疗上可用来治疗消化不良、胃酸过多等疾病。在环境保护方面,过氧化镁可用来处理地下水污染的土壤。还可以用于牙膏,对牙齿有漂白和防过敏的作用。某化学兴趣小组对过氧化镁的性质和制备等进行了以下研究。
一.过氧化镁的性质
(1)过氧化镁(其中氧元素的化合价为 __________)是一种白色的粉末,其外观与物理性质与氧化镁相似。化学性质不够稳定,不溶于水,但逐渐的被分解放出氧气。过氧化镁有强氧化性,常温下比较稳定,但是加热时会分解生成氧气和氧化镁。请下出该反应的化学方程式____________。
(2)过氧化镁易溶于稀盐酸,发生反应:MgO2+2HCl=MgCl2+H2O2同时温度升高,说明该反应_______________热量(填“放出”或“吸收”)。
二.过氧化镁的制备
下图是利用碱式碳酸镁【Mg2( OH)2CO3】和30%的过氧化氢溶液来制取过氧化镁。
【资料】①碱式碳酸镁与碳酸镁有相似的化学性质,能与稀盐酸反应产生二氧化碳
②氧化镁与过氧化氢反应放出大量的热
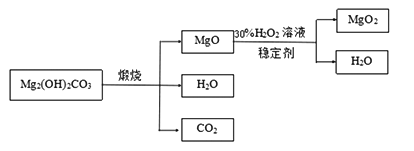
(3)检测煅烧过程碱式碳酸镁完全分解的方法是_________________(写出具体的操作和现象);上述生产过程加入稳定的剂的作用是_________________。
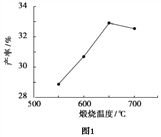
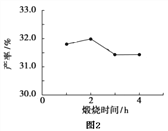
(4)用上述碱式碳酸镁在 550、600、650 及 700 ℃ 下煅烧一定的时间生成氧化镁。用上述条件制备的氧化镁分别与 30% 双氧水反应合成过氧化镁产率(见图1和图2)。碱式碳酸镁煅烧的温度适宜控制在______℃,煅烧的时间适宜控制在_____h。
(5)结果分析:在适宜的温度和时间下,碱式碳酸镁能完全分解,并且得到的氧化镁颗粒表面积最大,能与30%过氧化氢充分反应,所以产率高。推测700℃时,产率明显降低的可能的原因__________。
三.过氧化镁产品纯度检测
在生产过程中,过氧化镁中常常含有少量的氧化镁杂质(其他杂质不考虑),以下是该小组进行纯度检测的实验装置和实验步骤。
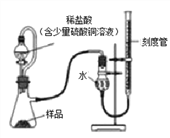
检查装置气密性,装入药品(样品质量为0.7g),调节刻度管使左右两边液面相平,刻度管度数为10.0mL。
打开分液漏斗开关,待瓶中无气泡产生时,关闭开关。
再次调节刻度管使左右两边液面相平,刻度管度数为122mL。
(6)稀盐酸中放入的少量硫酸铜溶液目的是__________________。
(7)根据上面实验数据计算样品中过氧化镁的质量分数__________(写出具体的计算过程,实验条件下O2密度为1.429g/L)。
(8)该小组同学所测得质量分数比实际结果偏大,你觉得可能的原因是(_______)
A.生成的氧气有少量溶于水 B.未等装置冷却到室温就开始读数
C.杂质与盐酸反应能产生少量的气体 D.滴入的稀盐酸占了一部分气体的体积
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是A.B两种物质的溶解度曲线,根据图示回答下列问题:
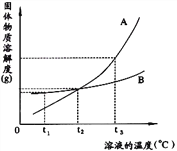
(1)t1℃时,向两只盛有100g水的烧杯中,分别加入A.B两种物质至不能溶解为止,所得溶液的溶质质量分数较大的是___________溶液(填“A”或“B”)。
(2)t2℃时,欲配制等质量的A.B两种物质的饱和溶液,所需水的质量关系是A___________B。 (填写“>”、“<”或“=”,下同)
(3)将t2℃的A.B两种物质的饱和溶液各200g,降温至t1℃,析出晶体的质量关系是A_______B。
(4)将t2℃的A、B两种物质的饱和溶液各200g,升温至t3℃,欲使它们仍为饱和溶液,若不改变溶剂质量,所需加入固体溶质的质量关系是A_______B。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铜是人类最早利用的金属之一。
(1)下列铜制品中,利用金属导热性的是____________(填字母序号)。

(2)“湿法炼铜”的原理是硫酸铜溶液与铁反应,该反应的化学方程式为______.
(3)利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如下(反应条件已略去):
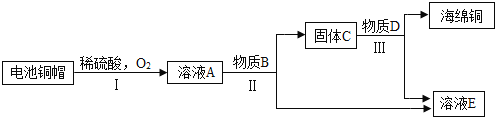
已知:2Cu+2H2SO4+O2=2CuSO4+2H2O
①过程Ⅱ中分离操作的名称是____________。
②A~E中含铜、锌两种元素的物质有____________(填字母序号)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】元素周期表是我们学习化学的重要工具。下表是小华绘制的元素周期表的局部,依据此表回答问题:
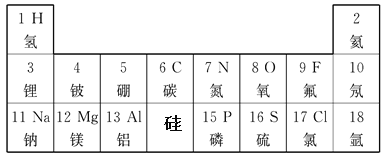
(1)第14号元素的元素符号为______;
(2)地壳中含量最多的元素为_______(填元素符号),其原子的质子数是______,在化学反应中它易______(填“得到”或“失去”)电子。
(3)钠元素在元素周期表中位于第________周期。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请根据A、B两种固体物质的溶解度曲线图回答下列问题。
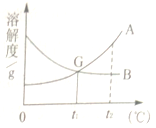
﹙1﹚温度为________℃时,A与B物质的溶解度相等;
﹙2﹚在保持其中溶解质量不变的条件下,将常温下B的不饱和溶液变成饱和溶液,可
行的方法是________。
﹙3﹚现有一杯t1℃时含A、B的两种物质且饱和的混合溶液,若要从中分离出A,其操作方法是______。
﹙4﹚下列说法正确的是________。
A.t2℃时,A溶液中溶质的质量分数一定比B溶液中溶质的质量分数大
B.将t2℃时A、B的饱和溶液分别降温至t1℃,此时两溶液中的质量分数相等
C.在t2℃时,用两份等量的水分别配制成A、B的饱和溶液,这两种溶液的质量相等
D.在t2℃时,用等量的A、B分别配制成两种饱和溶液,其质量分别mg和ng,则m
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】V2O3广泛应用于治金、化工等行业,实验室制取V2O3的流程如下:
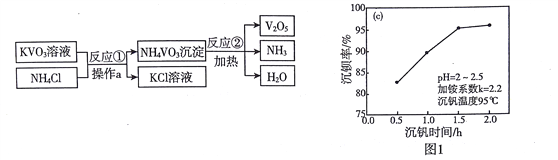
(1)KVO3中钒元素的化合价是_________
(2)操作a的名称是____________。图1表示反应①的沉钒率随时间变化的情况,为使生成沉淀的效率较高,反应①适合的时间是__________小时。
(3)反应②的化学方程式为____________,该反应的基本类型是________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铁矿石是怎样炼成铁的呢?某活动小组在实验室模拟了铁矿石炼铁化学原理,如图所示。
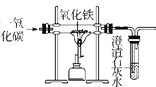
(1)该活动小组将实验装置组装好后,设计了下列实验操作步骤:①给玻璃管加热;②停止加热;③通入一氧化碳气体;④停止通入一氧化碳气体。
正确的操作步骤是____________(填序号);
(2)实验过程中,玻璃管中固体由________色变成________色,玻璃管中反应的化学方程式是____________________________________,试管中出现的现象是______________;
(3)图中有一处明显错误,请说明改进方法______________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳和碳的化合物是初中化学学习的重要内容。
﹙1﹚金刚石、石墨和C60都是由碳元素组成的单质,下列有关说法正确的是_____(填字母代号。)
A.都是黑色固体 B.硬度相同
C.完全燃烧都生成二氧化碳 D.碳原子的排列方式相同
﹙2﹚碳酸钠广泛用于玻璃、造纸、纺织和洗涤剂等的生产。
如何检验一瓶碳酸钠溶液中是否混有氢氧化钠?请简要写出实验步骤和现象___________。
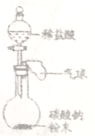
②下边是某趣味实验装置图,其气密性良好。打开分液漏斗的活塞后,可观察到气球胀大的现象。请用化学方程式解释产生此现象的原因 ___________。
﹙3﹚如下图是实验室中制取气体常用到的仪器,请回答下列问题:
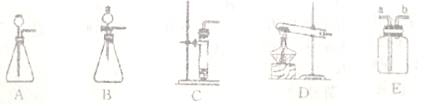
①请写出用D装置制取氧气的化学方程式:________________。
②实验室可用碳化钙(CaC2)固体和水反应来制取乙炔(C2H2)气体,该反应必须严格控制加水的速率,以免剧烈反应放热引起发生装置炸裂,则制取乙炔的最适合发生装置是________;若用E装置采用排水法来收集乙炔,乙炔气体从_____进(填“a”或“b”)。
(4)乙炔(C2H2)是一种重要的化工原料。常用碳化钙(CaC2)与水反应制取乙炔,同时生成氢氧化钙。若要制取5.2g乙炔气体,理论上需要碳化钙的质量是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com