
【题目】化学基础与常识
(1)下图金属应用的实例,主要利用金属的导热性的是_______(填序号);

A电缆 B.电热壶 C.金属丝 D.金属乐器
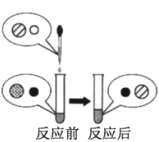
(2)向氢氧化钠溶液中滴加稀盐酸至恰好完全反应,反应前后溶液中存在的离子种类如图所示(其中“○”“![]() ”“●”“
”“●”“ ![]() ”表示不同离子)。则“○”与“
”表示不同离子)。则“○”与“![]() ”反应生成了_________(填物质名称)。
”反应生成了_________(填物质名称)。
(3)氢氟酸(HF)能刻画玻璃,其中有一个化学反应的化学方程式是:CaSiO3+6HF=X+SiF4↑+3H2O,则X的化学式为_______________
(4)氢能是一种极具发展潜力的清洁能。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示。

写出反应I中,发生反应的化学方程式:_____________________________。
【答案】 B 水 CaF2 SO2+I2+2H2O=H2SO4+2HI
【解析】(1) A、电缆是利用金属的导电性,故错误;B、电热壶利用金属的导热性,故正确;C、金属丝利用金属的延展性,故错误;D、金属乐器利用金属具有金属光泽、硬度大,故错误;(2) 氢氧化钠与稀盐酸反应生成氯化钠和水,中和反应的实质是氢离子和氢氧根离子结合生成水分子;(3)在化学反应CaSiO3+6HF=X+SiF4↑+3H2O中,反应前后原子的数目、种类都不变;反应前有6个氢原子、6个氟原子、1个硅原子、3个氧原子、1个钙原子;反应后除X外有6个氟原子、1个硅原子、6个氢原子、3个氧原子,因此每个X分子中应该有2个氟原子和1个钙原子,故X的化学式为CaF2;(4)据图可知,反应I中是由SO2、I2和2H2O生成H2SO4和2HI,反应的化学方程式:SO2+I2+2H2O=H2SO4+2HI。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】小华有一只银手镯(银锌合金),她想用实验探究手镯中银的含量。先用电子秤称得手镯的质量是25.00克,再用稀盐酸分多次与此手镯充分反应。实验数据如下表:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入烯盐酸的质量(克) | 10.00 | 10.00 | 10.00 | 10.00 | 10.00 |
充分反应后剩余固体的质量(克) | 24.35 | 23.70 | 23.05 | 23.00 | 23.00 |
根据上表中数据分析,完成下列问题:
(1)手镯中银的质量是________克。
(2)所用稀盐酸中溶质的质量分数是多少________?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】近年来,我国航空、航天、高铁等得到长足发展,跻身世界前列。大飞机C919试飞成功,标志着我国的航空强国梦又迈出了一大步。大飞机使用的化学材料如甲图。请回答:

(1)橡胶属于________(填“金属”或“合成”)材料。
(2)图乙是钛原子结构示意图,则x=_____;钛元素位于元素周期表第_____周期。
(3)铁比铝的强度大,但制造飞机却用铝合金而不用铁合金,主要原因是铝比铁的密度小且抗腐蚀性能强。铝具有很好的抗腐蚀性的原因是___________(用化学方程式表示)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学将锌和氧化锌的混合物20g放入烧杯中,加入一定质量分数的稀硫酸,测得加入稀硫酸的质量与产生氢气质量的关系如图所示。求:
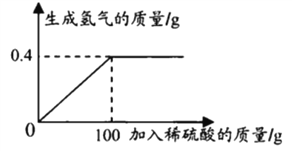
(1)恰好完全反应时生成氢气的质量是_______g;
(2)计算原20g混合物中氧化锌的质量分数_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
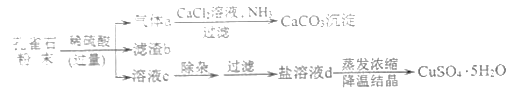
【题目】孔雀石主要成分为Cu2(OH)2CO3(难溶于水),还含有少量SiO2(难溶于水、不与稀硫酸反应)、Fe2O3等杂质。现以孔雀石为原料制取胆矾(CuSO4·5H2O)的部分工艺流程如图。
请回答:
(1)滤渣b的化学式为______。
(2)溶液c中的溶质有(写化学式):H2SO4、______、_______。
(3)盐溶液d的颜色为_______;实验室蒸发溶液时用到的玻璃仪器有_____(写1种)。
(4)在气体a生成CaCO3的过程中,发生反应:CO2+CaCl2+2NH3+H2O=CaCO3↓+2X,X的名称为_______;孔雀石与稀硫酸反应生成气体a的化学方程式为________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室常用2KClO3![]() 2KCl+3O2↑来制取O2,下列说法错误的是
2KCl+3O2↑来制取O2,下列说法错误的是
A. MnO2加快了反应速率
B. 该反应属于分解反应
C. 固体减少的质量等于生成O2的质量
D. 反应前后氯元素呈现的化合价分别为+3价和-1价
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某工厂的废水中含有MgSO4和FeCl3,技术人员逐渐加入NaOH溶液调节废水的pH,先后分离出两种沉淀,并通过系列处理得到有价值的产品。操作流程如下图所示。
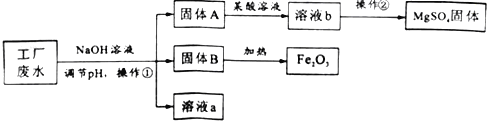
(1)固体A与某酸反应的化学方程式为____________。操作②时,当__________即可停止加热。
(2)固体B加热的产物是两种常见氧化物,则另一种氧化物的化学式为__________。
(3)溶液a除了可能含有NaOH外,还一定含有的溶质是_____________(填化学式)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在高温条件下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。小莉很好奇,设计如下实验探究铁粉与水蒸气反应后的产物。
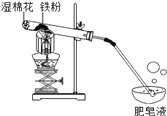
(1)试管尾部放一团湿棉花的目的是_____________________。
(2)探究生成的气体是什么?
用燃着的木条靠近飘到空中的肥皂泡,
有爆鸣声。说明生成的气体是_______。
(3)探究试管中剩余固体成分是什么?
【查阅资料】(1)常见铁的氧化物的物理性质如下表:
常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
能否被磁铁吸引 | 否 | 否 | 能 |
(2)稀盐酸(或稀硫酸)与铁反应产生气体,与铁的氧化物反应没有气体产生。
【初步验证】试管中剩余固体为黑色,能全部被磁铁吸引。
【猜想与假设】猜想一:剩余固体是Fe3O4;
猜想二:剩余固体是_____________。
【实验探究】根据猜想与假设,设计实验方案加以检验。
实验操作 | 实验现象 | 实验结论 |
____________________ | _________ | 剩余固体是Fe3O4 |
【实验结论】铁和水蒸气反应的化学方程式为____________________。
【反思与交流】该黑色固体不可能是Fe2O3,理由是___________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】空气是人类活动必需的自然资源。工业上常用分离空气的方法制取氧气,实验室常用物质分解的方法制取氧气。
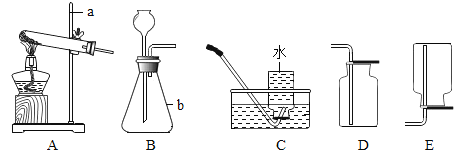
(1)工业制氧气是变化________(填“物理”或“化学”)变化。
(2)图中仪器a的名称是___________。
(3)实验室制取氧气,可选择_________装置(填字母代号),此法制取氧气的化学方程式为______________________。还可选择_________装置(填字母代号)此法制取氧气的化学方程式__________________收集氧气,可选择_________装置(填字母代号)
(4)检查B装置气密性的方法是(可借助水和图中的其他装置)__________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com