
【题目】化学用语是学习化学的重要工具。
⑴写出下列微粒的化学符号
①硅原子___ ②2个氨分子____③氧化铝中铝元素的化合价___ ④硫酸根离子____
⑵现有H、O、C、Na四种元素,请选用其中的元素写出下列物质的化学式:
①用于人工降雨或灭火______; ②制肥皂的碱_______;
③最清洁的燃料_______; ④治疗胃酸过多的盐______。
(3)用化学方程式表示下列事实:
①常温下,铝具有很好的抗腐蚀性能,是因为铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,反应的化学方程式是_______________;
②“冰洲石”(主要成分为CaCO3)制成的工艺品不能与盐酸接触,用化学方程式表示其原因:____;
③氯化铵与氢氧化钙混合加热____________________________ ;
④实验室用锌粒和稀硫酸反应制氢气________________________________。
【答案】 Si 2NH3 ![]() SO42- CO2 NaOH H2 NaHCO3 4Al+3O2=2Al2O3 CaCO3+2HCl=CaCl2+H2O+CO2↑ 2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O Zn+H2SO4=ZnSO4+H2↑
SO42- CO2 NaOH H2 NaHCO3 4Al+3O2=2Al2O3 CaCO3+2HCl=CaCl2+H2O+CO2↑ 2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O Zn+H2SO4=ZnSO4+H2↑
【解析】本题考查了常见化学用语的书写,书写时注意规范。
⑴①硅元素的元素符号可以表示硅原子,硅原子表示为Si;
②分子的表示方法是正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,2个氨分子表示为:2NH3;
③元素化合价的表示方法是确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后。氧化铝中铝元素的化合价表示为![]() ;
;
④离子的表示方法是在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,表示多个该离子,在其离子符号前加上相应的数字,硫酸根离子表示为:SO42-;
⑵①用于人工降雨或灭火是二氧化碳,化学式是CO2;②制肥皂的碱是氢氧化钠,化学式是NaOH;③最清洁的燃料是氢气,化学式是H2;④治疗胃酸过多的盐是碳酸氢钠,化学式是NaHCO3;
①常温下,铝具有很好的抗腐蚀性能,是因为铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,反应的化学方程式是4Al + 3O2=2Al2O3;
②CaCO3与盐酸反应生成氯化钙、水和二氧化碳,化学方程式是:CaCO3+2HCl == CaCl2+H2O+CO2↑;
③氯化铵与氢氧化钙混合加热生成氯化钙、氨气和水,化学方程式是:2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O;
④锌粒和稀硫酸反应生成氢气和硫酸锌,化学方程式是:Zn+ H2SO4 == ZnSO4 + H2↑。


科目:初中化学 来源: 题型:
【题目】欲测定某碳酸钠样品中碳酸钠的质量分数,取13.25g含有氯化钠杂质的碳酸钠样品,加入50g14.6%的盐酸溶液,二者恰好完全反应,试求:
(1)样品中碳酸钠的质量分数;(2)反应后溶液中氯化钠的质量分数.(结果精确到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在化学实验室里和日常生活中我们常常将固体药品配制成溶液进行化学反应。
(1)下图所示为氯化钠加入水中发生变化的微观过程示意图。
Ⅰ图表示氯化钠固体加入水中。
Ⅱ图表示水分子作用在氯化钠固体上。
Ⅲ图表示氯化钠固体以__________和__________(填写粒子符号)的形式向水中扩散,最终均一地分散到水分子中。

(2)如图是某试剂瓶标签上的内容。
浓硫酸(分析纯)
化学式:H2SO4 相对分子质量:98
密度:1.84g/cm3 质量分数:98%
①把这种浓硫酸稀释为19.6%的硫酸溶液200g需要这种浓硫酸的体积为__________mL(保留一位小数),需要水__________mL。
②稀释浓硫酸时,应注意的事项为__________。
A.直接在量筒中稀释 B.转移在烧杯中稀释
C.把浓硫酸沿器壁慢慢注入水中 D.把水沿器壁慢慢注入浓硫酸中
E.用玻璃棒不断搅拌
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在一烧杯中盛有22.3gNa2CO3和NaCl组成的固体混合物,加入109.1g水溶解,制成溶液。向其中滴加溶质质量分数10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系如图所示,请回答问题:

(1)写出发生反应的化学方程式_______________________。
(2)根据已知条件列出求解生成气体质量(X)的比例式_______________。
(3)当滴加稀盐酸至图B点时,烧杯中溶液的溶质名称是_______________。
(4)当滴加稀盐酸至图A点时,得到不饱和溶液,此时所得不饱和溶液中溶质的质量分数为________________。
(5)若用质量分数36.5%的浓硫酸配制146g上述稀盐酸,需要浓盐酸和水的质量最简比为________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向一定量稀硫酸中加入一定量铜粉,无气泡冒出;用导管向稀硫酸中通入空气并加热,铜粉逐渐减少,溶液由无色变为蓝色。测得溶液质量与实验时间的关系如下图。下列说法错误的是( )
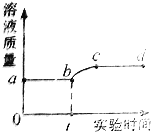
A.ab段说明Cu不能转换出硫酸中的氢
B.从b点到c点,溶液的PH逐渐增大
C.从c点到d点,溶液中的溶质只可能有一种
D.bc段发生的反应为2Cu+2H2SO4+O2 △ 2CuSO4+2H2O
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硫酸锌片在医药方面可用于治疗食欲不振、发育不良等症状,实验室可用锌和稀硫酸反应制得.学校化学兴趣小组的同学取一块表面严重氧化的锌片7.3g(不含其它杂质),剪碎,向其中慢慢滴加9.8%的稀硫酸,至恰好完全反应时,用去稀硫酸100g,并绘出如图所示的图象.小组同学将反应后的溶液经一系列操作,得到硫酸锌16.1g.
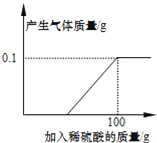
(1)小组同学在老师的指导下,配制200g 9.8%的稀硫酸.
①用98%的浓硫酸配制200g 9.8%的稀硫酸,需加水__g.
②将配制好的稀硫酸转移到试剂瓶中,贴上标签,标签上必须注明的是___(填序号).
A.200g B.9.8% C.稀硫酸
③下列操作中的___(填序号),可能会导致配制的溶液的溶质的质量分数低于9.8%.
A.量取浓硫酸后,置于空气中时间过长 B.量水时,俯视量筒刻度
C.配制前将烧杯用水冲洗干净,没有擦干
(2)生成0.1g氢气消耗的稀硫酸的质量是_____;
(3)该锌片没有氧化前的质量是____g.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】白云石粉是一种生产高级玻璃器皿、医药用瓶、光学玻璃的原料,某化学兴趣小组对白云石粉极其好奇,决定对其进行探究。
【查阅资料】
白云石属于碳酸盐矿物,白云石粉主要成分的化学式可表示为xMgCO3·yCaCO3 ( 杂质是二氧化硅,其不溶于水,也不与盐酸反应,受热不分解)
一、定性探究:白云石粉的成分和性质
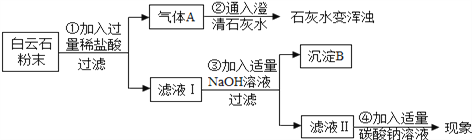
【实验分析】
(1)由步骤①②的现象可得出白云石粉中一定含有的离子是_________ (填离子符号)。
(2)步骤③生成氢氧化镁的化学方程式是________;步骤④的反应现象是_______。
【结论】综合上述实验现象可初步证明白云石由碳酸钙、碳酸镁组成。
【实验质疑】小组同学经过讨论认为:因氢氧化钙微溶于水,导致沉淀B中除了氢氧化镁之外应该还混有氢氧化钙,对定量测定白云石粉的组成干扰较大,在老师的指导下该兴趣小组采用热分解法进行定量探究。
二、定量探究:白云石的组成
【查阅资料】碳酸钙开始分解的温度为898℃,1000℃时完全分解生成生石灰和二氧化碳气体;碳酸钙与碳酸镁的化学性质相似;碳酸镁开始分解的温度为540℃,700℃时完全分解。
【实验设计】为测定白云石中的含钙量及x:y的值,该兴趣小组设计了如下装置并进行实验:

【实验步骤】
①组装仪器,检查装置的气密性;
②准确称取15.0g 白云石粉末放在A装置中,打开弹簧夹,鼓入一段时间氮气,称量B、C、D、E装置的质量;
③关闭弹簧夹,打开控温电加热器,缓缓调升温度至700℃,持续加热至固体质量不变;
④打开弹簧夹,缓缓鼓入一段时间氮气,准确称量B、C、D、E装置的质量;
⑤关闭弹簧夹,调升温度至1000℃,持续加热至固体质量不变,打开弹簧夹,缓缓鼓入一段时间氮气,准确称量B、C、D、E装置的质量。
实验数据记录如表:
B中溶液质量/g | C中溶液质量/g | D中溶液质量/g | E的质量/g | |
反应前 | 50.0 | 100.0 | 50.0 | 120.5 |
700℃ | 50.0 | 102.1 | 50.1 | 120.5 |
1000℃ | 50.0 | 106.3 | 50.3 | 120.5 |
【实验分析和数据处理】
(3)装置D的作用是______________________。
(4)持续加热至固体质量不变后缓缓鼓入一段时间氮气的目的是__________。
(5)计算白云石中钙元素的质量分数______。(写出计算过程,结果保留小数点后一位,)
(6)设计实验证明白云石粉已完全分解的实验方法是 ______(写出实验方法、现象、结论)
(7)白云石(xMgCO3·yCaCO3)中的 x:y=________ (最简整数比),若加热前没有鼓入一段时间的氮气,将会导致 x:y的值___________(填偏大、偏小或不变).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图为化学小组探究金属的化学性质所做的四个实验,回答下列问题:
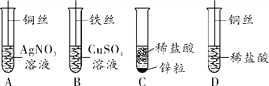
(1)写出溶液变蓝的反应的化学方程式______________________________。
(2)由上述实验能得出金属的活动性顺序是__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气中O2的体积百分数。

(1)实验前用10%的H2SO4溶液清洗铁钉至有气泡产生。用H2SO4溶液清洗的目的是__________。写出有关化学方程式______________________________。
(2)已知试管剩余空间和导管的体积为40 mL,导管截面积约为1 cm2,形成稳定液柱时,读取读数为8.2 cm。则空气中氧气的体积分数为______%。
(3)实验时发现上述测量过程因反应较慢耗时较长,对其影响因素作如下分析:
【提出假设】假设一:溶液的pH不同;
假设二:NaCl溶液的浓度不同;
请你再提出一种假设,假设三:______________________________不同。
【进行实验】借助上述实验装置,通过取体积、浓度相同NaCl溶液调节溶液的pH获得了如下实验数据:
pH | 2.0 | 5.5 | 6.0 | 6.5 | 7.0 | 8.0 |
液柱高度(cm) | 0 | 1.3 | 8.2 | 8.2 | 8.2 | 8.2 |
形成稳定液柱时间(min) | 3.0 | 3.0 | 5.1 | 5.3 | 15.6 | 17.5 |
【实验结论】根据实验数据分析,为缩短实验测定时间,pH的最佳范围是____________。
【实验反思】当pH=2时,没有观察到稳定液柱形成的原因是________________。
【注意:如果能正确回答下列问题,将奖励4分,但化学试卷总分不超过60分】
请你设计实验,探究NaCl溶液的浓度对铁生锈速率的影响。
实验步骤: __________________________________________________________。
实验现象:________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com