在我校实验室实施的扬州市2011年中考化学实验操作考查刚刚落下帷幕.实验考查中H
2O
2分解制氧气为何不采用MnO
2作催化剂?同学们为之展开了探究.
I、他们首先配制实验所需的50mL、6%的H
2O
2溶液.
[配制溶液]
现有一瓶新购置的双氧水,标签如图所示.
(1)若用这瓶双氧水来配置6%的医用双氧水1500g,需要这种双氧水的质量是多少克?
(2)另有一瓶5个月前购进的相同规格的双氧水,经检测,已缓慢分解放出了9.6g氧气,求现在剩余的该瓶溶液中溶质的质量分数.
II、然后同学们又比较了各催化剂在室温下对50mL、6%的H
2O
2溶液分解反应的催化作用情况.
[实验记录]各催化剂对50mL、6%的H
2O
2溶液分解反应的催化作用情况(室温22℃)
| 催化剂及用量 |
O2 平均产量 |
制氧所需时间 |
成本 |
反应情况 |
| MnO21.0g |
919mL |
10′03″ |
0.11元 |
分解先快后慢 |
| 10%FeCl3溶液5滴 |
985mL |
4′50″ |
0.02元 |
均匀产生O2 |
| 15%CuSO4溶液5滴 |
955mL |
4′57″ |
0.03元 |
均匀产生O2 |
[实验分析]由表中数据及实验体验可以得出,MnO
2 催化分解H
2O
2制氧气有两点不足,①开始反应速率过快,氧气产生后,发生装置内压强骤然增大,使用分液漏斗滴液往往受阻,收集氧气排水或排空气时稍微耽搁,就会有不少O
2 逸失,到收集最后一瓶O
2反应变慢,耗时太长.②
MnO2用量多,成本高
MnO2用量多,成本高
.
[提出问题]同学们认为用FeCl
3溶液作催化剂效果最好.但FeCl
3溶液为何能催化分解H
2O
2?
[实验猜想]已知FeCl
3在水中可解离出Fe
3+ 和Cl
-,同学们提出以下猜想:
甲同学的猜想是:真正催化分解H
2O
2的是FeCl
3溶液中的H
2O;
乙同学的猜想是:真正催化分解H
2O
2的是FeCl
3溶液中的Fe
3+;
丙同学的猜想是:真正催化分解H
2O
2的是FeCl
3溶液中的Cl
-;
你认为最不可能的是
甲
甲
同学的猜想,理由是
过氧化氢溶液中有水
过氧化氢溶液中有水
.
同学们对余下的两个猜想,用实验进行了探究,请你仔细分析后填空:
[实验过程1]向盛有5mL、6% H
2O
2溶液的试管中加入少量的HCl溶液,并把带火星的木条伸入试管.
[实验现象1]无明显现象.对应结论:
FeCl3溶液中的Cl-不能催化分解H2O2
FeCl3溶液中的Cl-不能催化分解H2O2
.
[实验过程2]另向盛有5mL、6%的H
2O
2溶液的试管中加入少量的
Fe(NO3)3溶液
Fe(NO3)3溶液
,并再次把带火星的木条伸入试管.
[实验现象2]
试管中有大量气泡产生,带火星的木条复燃
试管中有大量气泡产生,带火星的木条复燃
.
对应结论:
起催化作用的是Fe3+
起催化作用的是Fe3+
.
[拓展研究]
同学们还比较了FeCl
3和CuSO
4两种盐对H
2O
2分解的催化效果,他们分成甲、乙两组,分别设计了如图一、图二所示的实验并进行了实验.(设两种盐溶液的浓度等条件相同)
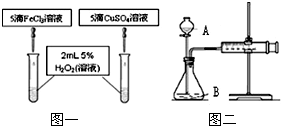
(1)指出仪器名称:A
分液漏斗
分液漏斗
B
锥形瓶
锥形瓶
(2)写出以FeCl
3为催化剂的反应的化学方程式
.
(3)图一可通过观察
反应产生气泡快慢
反应产生气泡快慢
来定性比较得出结论.有同学提出将药品CuSO
4改为CuCl
2更为合理,其理由是
使酸根相同,排除酸根的影响因素
使酸根相同,排除酸根的影响因素
,你认为药品还可以作何改进?
将FeCl3改为Fe2(SO4)3
将FeCl3改为Fe2(SO4)3
.
(4)检查图二装置气密性的方法是:
关闭
关闭
(填“打开”或“关闭”)仪器A的活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察到活塞又回到了原位,则说明装置气密性
良好
良好
(填“良好”或“不好”).该组同学利用图二所示实验需测量的数据是
A
A
(填序号:A.一定时间内收集到的气体体积 B.收集一定体积的气体所需双氧水的质量).
研究小组还对溶液浓度、温度等实验条件进行了探究.下表选取了部分实验数据:
用足量等体积H
2O
2溶液制取相同体积O
2所需的时间
浓度
时间(min)
条件 |
30% H2O2 |
15% H2O2 |
5% H2O2 |
| 加入a g MnO2 |
0.2 |
0.8 |
2.0 |
[交流讨论]从上表中还能得出的结论是:
H2O2溶液的质量分数越大产生氧气的速率越快
H2O2溶液的质量分数越大产生氧气的速率越快
.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
 在我校实验室实施的扬州市2011年中考化学实验操作考查刚刚落下帷幕.实验考查中H2O2分解制氧气为何不采用MnO2作催化剂?同学们为之展开了探究.
在我校实验室实施的扬州市2011年中考化学实验操作考查刚刚落下帷幕.实验考查中H2O2分解制氧气为何不采用MnO2作催化剂?同学们为之展开了探究.