
【题目】2019年诺贝尔化学奖三位得主研制出锂离子电池,目前被广泛应用于便携电子设备和新能源汽车。如图是锂元素的原子结构示意图及其在周期表中的相关信息。
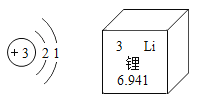
(1)锂元素位于元素周期表中第___周期,在化学反应中容易____(填“得到”或“失去”)最外层电子,所形成的离子符号为______。
(2)研究表明,锂的金属活动性比较活泼。锂与稀硫酸反应的化学方程式为______,该反应的基本类型为________。
(3)氢氧化锂与氢氧化钠的化学性质相似,氢氧化锂与二氧化碳反应的化学方程式为____,在航天舱内如果要吸收航天员呼出的二氧化碳气体,用氢氧化锂比氢氧化钠更理想,分析其原因是_____。
(4)如今锂离子电池是我们生活中必备的能量源。锂离子电池具有的一个优点是________。
【答案】二 失去 Li+ ![]() 置换反应
置换反应 ![]() 相同质量的氢氧化锂吸收二氧化碳的质量是氢氧化钠的1.67倍 轻巧耐用、安全可靠、充电快、能量强大、无污染等(写出一个即可)
相同质量的氢氧化锂吸收二氧化碳的质量是氢氧化钠的1.67倍 轻巧耐用、安全可靠、充电快、能量强大、无污染等(写出一个即可)
【解析】
(1)锂元素核外有2个电子层,位于元素周期表中第二周期,最外层电子数为1,在化学反应中容易失去最外层电子,所形成的离子符号为Li+。
(2)研究表明,锂的金属活动性比较活泼,锂与稀硫酸反应生成硫酸锂和氢气,反应的化学方程式为![]() ,该反应的基本类型为置换反应。
,该反应的基本类型为置换反应。
(3)氢氧化锂与氢氧化钠的化学性质相似,氢氧化锂与二氧化碳反应生成碳酸锂和水,反应的化学方程式为![]() ,在航天舱内如果要吸收航天员呼出的二氧化碳气体,用氢氧化锂比氢氧化钠更理想,根据氢氧化锂、氢氧化钠与二氧化碳反应的质量关系:
,在航天舱内如果要吸收航天员呼出的二氧化碳气体,用氢氧化锂比氢氧化钠更理想,根据氢氧化锂、氢氧化钠与二氧化碳反应的质量关系:![]() 、
、![]() ,故其原因是相同质量的氢氧化锂吸收二氧化碳的质量是氢氧化钠的1.67倍。
,故其原因是相同质量的氢氧化锂吸收二氧化碳的质量是氢氧化钠的1.67倍。
(4)如今锂离子电池是我们生活中必备的能量源,锂离子电池具有的一个优点是轻巧耐用、安全可靠、充电快、能量强大、无污染等(写出一个即可)。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:初中化学 来源: 题型:
【题目】10℃时,在两个烧杯中分别盛有相同质量的硝酸钾和氯化钾饱和溶液;保持溶液温度不变,分别向其中加入等质量的相应溶质;再将温度升高到40℃,氯化钾和硝酸钾的溶解情况如图1所示。图2为两种物质的溶解度曲线。请仔细观察、分析图1和图2,回答下列问题:

(1)当温度t的取值范围为_________时,硝酸钾的溶解度大于氯化钾的溶解度。
(2)烧杯甲盛放的是_________溶液。
(3)状态三时,烧杯_______中溶剂水的质量相对较小。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在今年化学实验操作考试“探究纯碱的性质”中,同学们做了如图所示的四组实 验,并将 A、B、C、D 四支试管中的废液全部倒入一个干净的大烧杯中。考试结束后,某兴趣小组发现大烧杯底部有沉淀,上层溶液呈红色。为了探究上层溶液的成分,进行了以下实验。
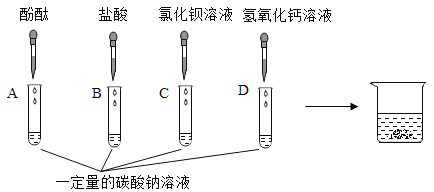
(提出问题)大烧杯中的上层溶液中除了含有水和酚酞外,还含有哪些离子?(假设难溶物质、水和酚酞均不会解离出离子)
(猜想假设)小明认为上层溶液中一定含有 Na+、CO32-、H+、Cl-、Ba2+、Ca2+、OH-七种离子,你认为上层溶液中含有的离子最多可能有______________种。
(分析讨论)小红认为上层溶液中一定不含有H+,因为是____________。小李取一 定量的上层溶液于试管中,滴加几滴稀盐酸,发现无气泡产生,认为上层溶液中一 定不含有CO32-,小红认为他的结论不正确,原因是_______________________。
(设计实验)为进一步确定上层溶液中是否含有CO32-,请你和小红一起参与下列探究
实验操作 | 实验现象 | 实验结论 |
取大烧杯中的上层 溶液少许于一支试 管中,滴加__________, 静置 | ____________;试管中的上层溶液仍是红色 | 大烧杯中的上层溶液中一定含有CO32,发生的化学反应方程式为________ ;同时还能得出大烧杯中的上层溶液中一定含有的阴离子是____ (填 离子符号) |
(实验结论)大烧杯中的上层溶液中一定含有的离子是_____________ (填离子符号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】稀土金属因其独特的性能而被誉为“新材料之母”。稀土金属钇的氧化物(Y2O3)广泛应用于航空航天涂层材料,其颗粒大小决定了产品的质量。利用富钇稀土(含Y2O3约70%,含Fe2O3、CuO、SiO2等约30%)生产大颗粒氧化钇的一种工艺如下:
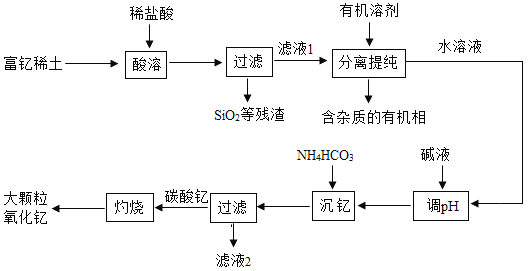
(1)“酸溶”过程中,氧化钇与盐酸反应的化学方程式是______。
(2)“分离提纯”是为了除去滤液1中的_______(填化学式)。
(3)碳酸钇灼烧分解的化学方程式是______。
(4)为了获得大颗粒氧化钇,某小组研究了条件对产品直径的影响,相关数据如表(D50表示颗粒直径):
实验编号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
沉淀反应温度/℃ | 60 | 80 | 85 | 93 | 93 | 93 |
料液浓度/(kgL) | 30 | 30 | 30 | 30 | 40 | 40 |
灼烧温度/℃ | 1100 | 1100 | 1100 | 1100 | 1100 | 1100 |
氧化钇D50/μm | 6.00 | 21.65 | 35.99 | 38.56 | 35.99 | 61.34 |
分析表中数据,其他条件不变时,若将灼烧温度均升高至1400℃ ,预期所得氧化钇D50最大的是___(填实验编号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】室温时,氢氧化钠溶液与稀硫酸用滴加方式进行反应,如图是氢氧化钠溶液与稀硫酸恰好完全反应的微观示意图,下列叙述正确的是( )
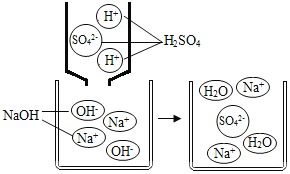
A.反应前的溶液均可导电,反应后的溶液不导电
B.该反应的实质是Na+和SO42-反应生成Na2SO4
C.反应前后,所有元素的化合价均无变化
D.该微观示意图说明物质都是由分子构成的
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】牙膏中常用碳酸钙、二氧化硅等物质作为摩擦剂。某同学对牙膏中摩擦剂碳酸钙的含量进行探究。
(实验原理)测定C装置中生成的BaCO 3 沉淀的质量,通过计算确定牙膏中CaCO3的质量分数。
(查阅资料)CO2+Ba(OH)2=BaCO3↓+H2O,牙膏中其他成分遇到盐酸时无气体产生。
(实验装置)
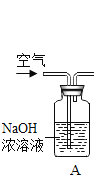
根据探究过程回答下列问题:
(1)装置A中氢氧化钠溶液的作用是_____。若没有A装置,直接通入空气,则测得CaCO3的质量分数_____(填“偏大”、“偏小”或“不变”)。装置B中发生反应的化学方程式为_____。
(2)实验过程中需持续缓缓通入空气,其作用有:①搅拌B、C 中的反应物,使其充分反应;②_____。
(3)从C中过滤出BaCO3沉淀,所需的玻璃仪器有烧杯、_____和玻璃棒。
(4)只要测定装置C在吸收CO2前后的质量差,同样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,分析的原因是_______。
(5)为提高测定准确度,应采取必要措施,其中能达到目的的是____(填序号)。
①在加入盐酸之前,排净装置内的CO2气体
②放慢滴加盐酸的速度
③在A~B之间增添盛有浓硫酸的洗气装置
④在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取三份牙膏样品,每份4.0g,进行三次测定,测得生成BaCO3的平均质量为1.97g。则样品中CaCO3的质量分数为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是3种物质的溶解度曲线。下列叙述正确的是( )
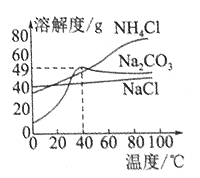
A. 0℃时,NaCl的溶解度小干NH4Cl的溶解度
B. 40℃时,饱和Na2 CO3溶液的溶质质量分数为49%
C. 将饱和Na2 CO3溶液由80℃冷却至40℃时,有固体析出
D. 80℃时,分别将等质量的NH4Cl和NaCl固体溶于适量的水,恰好均配成饱和溶液,所得溶液的质量前者小于后者
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】草莓、香蕉等水果具有芳香气味,是因为其中含有乙酸乙酯(化学式为C4H8O2)等物质。下列关于乙酸乙酯的说法正确的是( )
A.该物质中碳、氢、氧质量比12︰1︰16B.其分子由碳原子、氢原子和氧分子构成
C.该物质属于氧化物D.该物质的相对分子质量为88
查看答案和解析>>
科目:初中化学 来源: 题型:
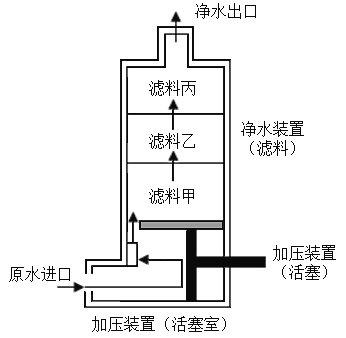
【题目】为了解决人们在野外生活和工作时的饮水问题,小金开展了便携式野外净水器的设计和制作。设计方案如图所示(其中箭头表示预设的水流方向)。为了使水质符合饮用水标准,小金选择了三种滤料去除原水中的杂质,三种滤料的用途如表所示,则滤料甲、乙、丙分别为_____(按序填写编号)。
滤料编号 | 用途 |
① | 去除水中的泥沙、悬浮物等大颗粒污染物 |
② | 去除大分子有机物、重金属离子和细菌等 |
③ | 去除残留的细菌、小分子有机物、重金属离子和异味等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com