
【题目】如图表示通电分解水的简易装置.回答下列问题:
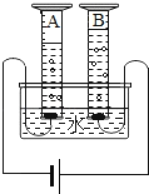
(1)与A量筒中的电极相连接的是电池的_____极,B量筒中产生的气体是_____.
(2)如果用VA和VB分别表示A量筒和B量筒中生成气体的体积,则VA:VB约等于_____.
(3)如果该实验中产生氧气32g,则生成氢气_____g.
(4)该实验能证明的结论是:①_____;②_____.
科目:初中化学 来源: 题型:
【题目】如图中的①、②分别是氟元素、钙元素在元素周期表中的信息,A、B、C、D分别是四种粒子的结构示意图。根据题中信息回答:
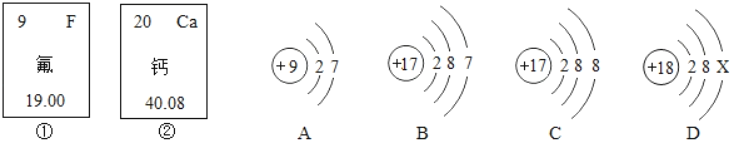
(1)氟原子的核电荷数为_____,钙元素的相对原子质量为_____。
(2)X=_____;A、B、C、D中属于同种元素的粒子是_____(填序号)。
(3)A粒子的化学性质与B、C、D中哪一种粒子的化学性质相似_____(填序号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】家里厨房中使用的食用碱(主要成分碳酸钠)中往往含有少量的氯化钠,某化学兴趣小组的同学通过实验来测定某品牌的食用碱样品中碳酸钠的质量分数。他们实验的过程和数据如图所示。
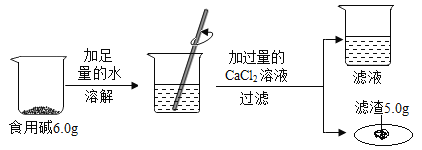
(1)该反应的化学方程式是_____;
(2)加入过量的CaCl2溶液的目的是_____;
(3)计算:该食用碱中碳酸钠的质量分数是______?(计算结果精确至0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】锌是人体生长发育过程中必不可少的元素,被誉为“生命之花”,葡萄糖酸锌口服液是以葡萄糖酸锌[化学式为(C6H11O7)2Zn]为主要原料制成的保健品,具有补锌功能。请阅读产品说明后回答:
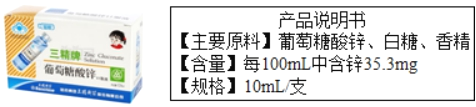
(1)葡萄糖酸锌的相对分子质量是_____;
(2)成人保健每天需服用两支,可补锌_____毫克;
(3)计算葡萄糖酸锌中碳元素的质量分数。_____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业纯碱中常含有少量的氯化钠。某学习小组对其组成展开探究。现取24g纯碱样品,加入100g水使其完全溶解,再加入96g过量的氯化钙溶液,完全反应后,过滤、洗涤、干燥得沉淀20g。完成下列问题:
(1)反应后溶液中含有的溶质是_____。(写化学式)。
(2)通过已知数据,能求出的量有_____(写字母序号)。
A.反应后溶液的总质量
B.参加反应的氯化钙的质量
C.样品中碳酸钠的质量分数
D.氯化钙溶液中溶质的质量分数
(3)计算反应后溶液中氯化钠的质量分数为_________。(写出计算过程,结果保留到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图为铝原子的原子结构示意图及铝元素在元素周期表中的相关信息,请根据图示回答下列有关问题:
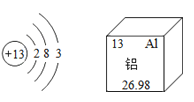
(1)铝原子的原子序数为 ;
(2)铝元素的相对原子质量为 ;
(3)铝元素属于 (填“金属”或“非金属”)元素;
(4)铝原子在化学反应中容易 (填“得到”或“失去”)电子;
(5)铝元素与地壳中含量最多的元素形成的化合物是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下列装置图,回答有关问题:

(1)写出有标号的仪器名称:a ,b .
(2)实验室选用A、F装置制取氧气,化学方程式为 .
(3)实验室用石灰石和稀盐酸制取二氧化碳的化学方程式为 ,若要得到平稳的气流,应选择的发生装置是 (填字母),选用D装置收集二氧化碳的原因是 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是由氢元素和氧元素组成的,下列有关说法正确的是( )
A. 氧离子的结构示意图
B. H2O和H2O2中氢元素的化合价相同
C. 电解水实验中氢气和氧气的质量比为2:1
D. 水沸腾时可冲起壶盖,说明温度升高水分子变大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】石灰石是一种常见的矿物,其主要成分为碳酸钙。石灰石在工农业生产和实验室中均有重要的应用。探究小组利用石灰石开展如下实验,根据要求回答问题:
实验Ⅰ:制取二氧化碳。实验室有如下仪器装置供选择。
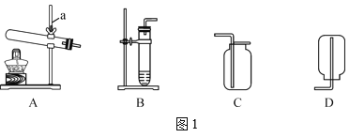
(1)仪器a的名称是______。
(2)制取和收集CO2时,应选择______和______;制取的化学方程式是______。
(3)实验过程中,为检验集气瓶中二氧化碳是否收集满,所采取的实验方法为(含操作、现象和结论)______。
实验Ⅱ:煅烧石灰石,检验分解产物。
(4)煅烧石灰石的化学方程式为______。
(5)取适量产物与足量水充分反应后静置,取上层清液通入CO2,观察到清液______,即可证明产物中含氧化钙。CO2通入清液中,所发生反应的化学方程式为______。
实验Ⅲ:研究不同温度下煅烧石灰石所得分解产物氧化钙的活性。
(6)已知:生石灰的活性受煅烧温度影响,生石灰活性越高,其化学反应能力越强。探究小组取三份等质量的石灰石样品,分别于800 ℃、900 ℃和1 000 ℃条件下煅烧15分钟,并将煅烧所得的三份固体产物分别放入盛有等质量水(足量)的三个烧杯中,测得烧杯内反应液的温度随时间的变化如图2所示。由此可推知:
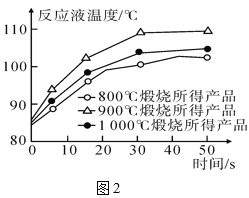
①CaO与水反应______热量(填“放出”或“吸收”);______ ℃煅烧所得CaO活性最高。
②实验时,需要控制煅烧温度、石灰石样品质量、水的用量以及______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com