
【题目】某厂生产的纯碱中含有少量氯化钠。取12 g该样品于烧杯中,并滴加稀盐酸至73g时,气泡不再冒出,此时称得烧杯内溶液的总质量为80.6g。请计算:
(1)产生二氧化碳气体的质量是________g;
(2)反应后溶液中溶质的质量分数________
科目:初中化学 来源: 题型:
【题目】“HDPE”膜广泛应用于环保、水利等工程的防渗施工中。老师告诉同学们“HDPE”膜具有极好的抗冲击性和防潮性,火神山医院在建造过程中也用到了“HDPE”膜。听完老师的介绍,同学们对“HDPE”的组成元素产生了兴趣,设计并进行了如下探究。
(提出问题)“HDPE”由什么元素组成?
(查阅资料)①“HDPE”能够燃烧,燃烧可能生成一氧化碳;
②碱石灰主要成分是氢氧化钠固体和氧化钙固体。
(实验探究)如图所示,先通入干燥的氮气,再将4.2g的“HDPE”样品(不含杂质)在一定质量的氧气中点燃,并将燃烧产物依次通过装置A、B、C、D(装置中每步反应均进行完全)。
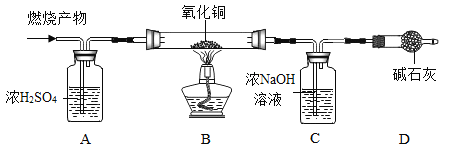
(实验记录)
装置质量 | A 装置总质量 | C 装置总质量 |
实验前 | 100.0g | 100.0g |
实验后 | 105.4g | 113.2g |
(实验分析)
(1)装置A的作用是_____。
(2)实验中观察到装置B中黑色粉末变成红色,写出该装置中发生的化学反应方程式_____。
(3)实验完毕后,先停止加热,继续通入氮气直至玻璃管冷却至室温。继续通入氮气的目的之一是_____。
(实验结论)
(4)根据实验所得数据,分析可知“HDPE”中一定含_____(填元素名称)。
(反思拓展)
(5)实验中的4.2g“HDPE ”样品燃烧消耗的氧气质量为m,则m的取值范围为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】日常生活中接触的金属材料,大多属于合金。其中黄铜是以锌作主要添加元素的铜合金。已知组成某弹壳的黄铜中只含有锌和铜,现将22g该弹壳碾成粉末后放入盛有足量的稀硫酸烧杯中,测得反应过程中生成的氢气的质量(单位为g)与反应时间(单位为min)的关系如图所示。试计算:
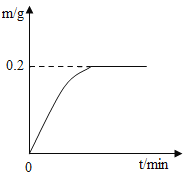
(1)实验室中将100g溶质质量分数98%的浓硫酸,加水稀释成19.6%的稀硫酸,加水的质量是_____。
(2)弹壳中铜的质量(写出解题过程)。
(3)实验过程中将弹壳粉碎的目的是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列化学方程式书写正确的是( )
A.Fe+2AgNO3═Fe(NO3)2+2AgB.2NaOH+K2CO3═2KOH+Na2CO3
C.2H2O2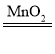 2H2↑+O2↑D.Fe2O3+2H2SO4═2FeSO4+2H2O
2H2↑+O2↑D.Fe2O3+2H2SO4═2FeSO4+2H2O
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示是甲、乙两种固体物质的溶解度曲线,回答下列问题:
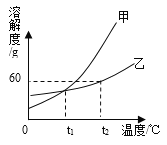
(1)p点的含义____________________________。
(2)若甲中含有少量的乙,则提纯甲可以采用的方法是___________。
(3)t2℃时,把50g乙物质放入50g水中,充分搅拌,所得溶液质量是_____g。
(4)t2℃时,配制等质量的甲乙两种饱和溶液需要水的质量:甲____乙(>;<;=)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】X、Y、Z、W是初中化学常见的四种非金属元素。X的一种原子没有中子,Y的一种单质可用于制铅笔芯,Z是地壳中含量最高的元素,W2是空气中含量最高的单质。请回答下列问题:
①Y的另一种单质是天然存在的最硬的物质,该单质的名称为_____,![]() 的离子结构示意图为_____。
的离子结构示意图为_____。
②K、Z、W三种元素可形成一种盐,该盐是一种常见的化肥,其化学式为_____。
③实验室检验YZ2时发生反应的化学方程式为_____。
④钠与Z形成的化合物Na2Z2常用作潜水艇中的供氧剂,因为Na2Z2与YZ2反应生成Na2YZ3和Z2,写出该反应的化学方程式_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】计算题:.将一定质量金属Mg和稀盐酸恰好完全反应,产生气体的质量0.4g。
(1)反应后溶液中溶质MgCl2 的质量为_____g。
(2)向反应后的溶液中逐滴加入NaOH 溶液,当加入的NaOH 溶液质量为40g 时,恰好完全反应,此时生成沉淀的质量为_____g。
(3)计算所加NaOH 溶液的溶质质量分数是多少?_____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硫酸铜是一种应用极其广泛的化工原料,易溶于水而不易溶于酒精;铜离子完全沉淀的pH是5左右,铁离子完全沉淀的pH是2左右.以下是某工厂用含铁废铜为原料生产胆矾(CuSO4·5H2O)和副产物石膏(CaSO4·2H2O)的生产流程示意图:
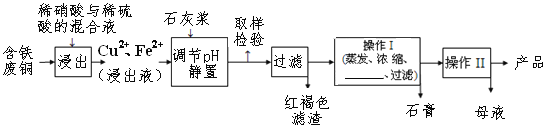
胆矾和石膏在不同温度下的溶解度(g/100g水)如表。
温度(℃) | 20 | 40 | 60 | 80 | 100 |
石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
请回答下列问题:
(1)红褐色滤渣的主要成分是____________;
(2)石灰浆调pH大约要调节到__________
A. 2 B. 5 C. 7 D.10
(3)含铁的废铜和稀硫酸反应的化学方程式________________________________;
(4)操作I最后温度应该控制在___________℃左右;
(5)从溶液中分离出硫酸铜晶体的操作Ⅱ应为蒸发浓缩、__________、过滤、洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组为测定实验室中一瓶久置的过氧化氢溶液中溶质的质量分数,实验测得相关数据如图所示:

(1)反应生成氧气的质量为__g.
(2)计算该过氧化氢溶液中溶质质量分数___.
(3)实验表明硫酸铜溶液在该反应中也能起到二氧化锰的作用.若用5.6g无水硫酸铜代替二氧化锰进行本实验,计算剩余的溶液中溶质的质量分数___.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com