
| A. | -1 | B. | +3 | C. | +5 | D. | +7 |
科目:初中化学 来源: 题型:实验探究题
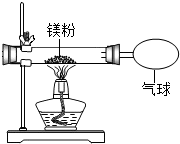 某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.
某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.| 实验操作 | 实验现象及结论 |
| 取少量黄色固体于试管中,加入适量的水,并将湿润的红色石蕊试纸放在试管口 | 试管中有气体产生,湿润的红色石蕊试纸变蓝.证明猜想正确. |
| 实验序号 | 实验1 | 实验2 | 实验3 | |
| 与镁条反应的溶液 | NH4Cl | NaCl | Na2SO4 | H2O |
| 实验现象 | 有大量气泡产生 | 有较多气泡产生 | 有少量气泡产生 | 气泡较少 |
| 加热后,实验现象 | 气泡明显增多可闻到氮味 | 气泡增多 | 气泡增多 | 气泡增多 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
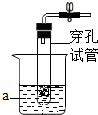 利用一个底部有小孔的废旧试管,辅以其它仪器和药品,配装成一个实验室制取气体的装置,请回答下列问题.
利用一个底部有小孔的废旧试管,辅以其它仪器和药品,配装成一个实验室制取气体的装置,请回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:推断题
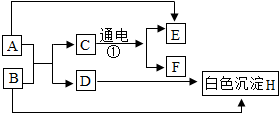 A-H是初中化学常见的物质,其相互转化关系如图所示,其中A是人体胃液中帮助消化的物质,B用于改良酸性土壤.
A-H是初中化学常见的物质,其相互转化关系如图所示,其中A是人体胃液中帮助消化的物质,B用于改良酸性土壤.查看答案和解析>>
科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 2015年10月我国科研人员首次宣布在自然界中发现金属铀,铀元素的相关信息如图,下列有关铀的说法不正确的是( )
2015年10月我国科研人员首次宣布在自然界中发现金属铀,铀元素的相关信息如图,下列有关铀的说法不正确的是( )| A. | 属于金属元素 | B. | 原子核内中子数为92 | ||
| C. | 相对原子质量为238.0 | D. | 金属铀的化学式为U |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 试管(盛有同体积同浓度的盐酸) | ① | ② | ③ | ④ |
| 镁条长度 | 1cm | 2cm | 3cm | 4cm |
| 相同的实验现象(省略题干现象) | 快速反应,试管发热,镁条全部消失 | |||
| 沉淀量差异(恢复至20℃) | 无 | 少量 | 较多 | 很多 |
| 试管 | 操作 | 现象 | 结论 |
| A | 加入足量盐酸 | 没有气泡产生,白色沉淀消失 | 猜想一不正确,但这种白色沉淀能溶于盐酸 |
| B | 加入足量水 | 白色沉淀不消失 | 猜想二不正确 |
| C | 加入适量稀硝酸 | 白色沉淀消失 | 原白色沉淀中含有的离子是: Mg2+、Cl- |
| 继续滴加几滴硝酸银溶液 | 出现大量白色沉淀 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 高铁酸钾[K2FeO4]能溶于水,是高效、多功能水处理剂.
高铁酸钾[K2FeO4]能溶于水,是高效、多功能水处理剂.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com