
【题目】已知:Ca(HCO3 )2![]() CaCO3+CO2↑+H2O.下列图象表示一定质量的 Ca(HCO3)2 受热过程中某些量随时间的变化趋势(该过程的 CaCO3 不分解),其中不正确的是( )
CaCO3+CO2↑+H2O.下列图象表示一定质量的 Ca(HCO3)2 受热过程中某些量随时间的变化趋势(该过程的 CaCO3 不分解),其中不正确的是( )
A. 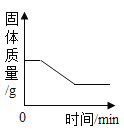 B.
B. 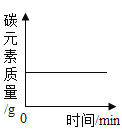
C. 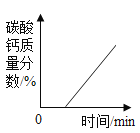 D.
D. 
 阶梯计算系列答案
阶梯计算系列答案科目:初中化学 来源: 题型:
【题目】资料表明:有许多金属的化合物对双氧水的分解具有催化作用。为比较含铁化合物和含铜化合物对H2O2分解的催化效果,某同学设计了如图所示的实验。请回答
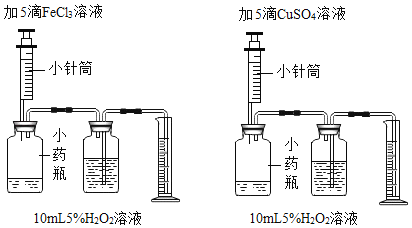
(1)小药瓶内原有的空气是否会影响催化效果的比较_____(填是或否)
(2)本实验还需要一个工具:_____。借助于该工具,实验可过观察_____来得出结论。
(3)有同学提出将药品CuSO4改为CuCl2更为合理其理由是_____你认为还有什么其它改进方法?_____。
(4)如要比较过氧化氢溶液在不同温度的分解速度,请设计一个对比试验并用文字表述_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图

Ⅰ.实验一:(1)写出仪器a的名称:________。
(2)图②中熄灭酒精灯的操作是________。
(3)图④在整个实验设计中的意图是________,发生的现象是________。
Ⅱ实验二:(4)B装置和A装置相比,优点是_________。
(5)采用气密性良好的B装置,使红磷充分燃烧后冷却至室温,再打开弹簧夹,发现进入的水少于集气瓶容积的五分之一,可能的原因是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请阅读下列叙述后。回答问题
小葵查询相关资料后,知道要配制某种浓度的NaOH水溶液100mL,需加入NaOH 16.0g。如图的步骤一至步骤四为她在室温下进行此浓度溶液配制,以及溶液密度测量的步骤示意图。步骤四完成后,经老师提醒,才知道烧杯上的刻度标示仅为参考之用,误差较大。所以小葵待溶液温度回到室温后,再以量筒测量溶液的总体积如步骤五所示。
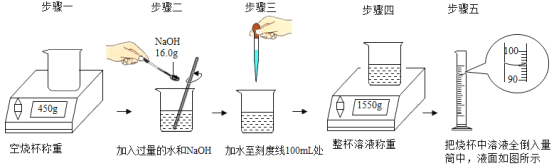
依测量的结果可知,用此方法和器材配制溶液确实会有较大的误差。应改用容量瓶等器材来配制溶液。小葵实际配制出的溶液密度最接近下列何者?( )
A.0.86g/cm3B.1.10g/cm3C.1.16g/cm3D.1.22g/cm3
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用久的热水瓶内胆有一层水垢(主要成分是CaCO3和Mg(OH)2)。兴趣小组为了解具体成分进行了实验。他们取样品25克放入质量为100克的锥形瓶中,置于电子天平上,往瓶内加入150克稀盐酸时,恰好完全反应(样品中的杂质不与稀盐酸反应),此时天平示数如图。对所得混合物进行过滤、洗涤、干燥、称量,得到固体4.2克。请回答下列问题:

(1)恰好完全反应时,溶液中的溶质为_____(填化学式)。
(2)样品中CaCO3的质量分数是_______?
(3)反应结束时溶液中MgCl2的质量分数是___________?(精确到0.1%)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列字母 A~H 表示初中化学常见的物质,它们由氢、碳、氧、氯、钠、钙、铁中的 2﹣3种元素组成.
(1)A 有强烈的腐蚀性,易潮解,无色酚酞溶液遇A的稀溶液变红,A 的俗称是_____.
(2)红色粉末B与气体C反应得到黑色粉末,化学方程式为_____.
(3)D和E均含两种元素.如图所示,将D的溶液滴入锥形瓶中,溶液变黄,有气泡产生;烧杯中聚集的肥皂泡能被点燃.E中含有的元素是_____,锥形瓶中发生反应的化学方程式为_____.
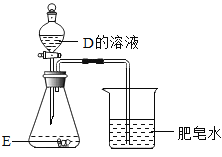
(4)F、G、H 分别与D的溶液反应,均有水生成.将F的溶液与G的溶液混合,生成 白色沉淀H.F与G反应的化学方程式为_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有以下仪器,请回答下列问题:

(1)仪器⑥的名称是_____;取用粉末状固体必须用到的仪器是_____(填名称)。
(2)如果用加热高锰酸钾的方法制取氧气,收集较纯氧气的方法用_____;其化学方程式为_____。
(3)如果用过氧化氢溶液分解来制取氧气,发生装置最好选用仪器_____(填序号),
(4)实验室里用加热高锰酸钾的方法制取氧气,并用排水法收集氧气实验时,待气泡放出时,不宜立即收集,其原因是_____;应待气泡_____冒出时,再收集。实验结束时应先_____,然后_____,原因是_____;
(5)检验O2是否已经集满的方法是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下列实验装置图,按要求回答有关问题:
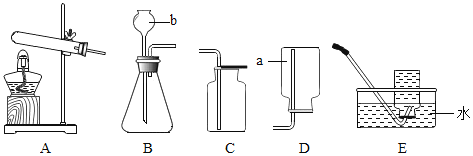
(1)写出图中带有标号仪器的名称:a_____、b_____。
(2)图A中管口略向下倾斜的原因是_____;
(3)实验室制取氧气前,必须检查装置的_____;
(4)实验室用氯酸钾和二氧化锰混合物的方法制取并收集的装置是 _____,其基本反应类型是_____反应,其中二氧化锰起_____作用,反应的符号表达式为_____。
(5)若实验室用加热高锰酸钾的方法制取氧气,在试管口处放_____,其作用是_____。
(6)若将A与E相连,用加热高锰酸钾固体欲制取并收集氧气,涉及到的主要实验操作有:a.检查装置气密性 b.装药品并在试管口放一团棉花,固定试管;用集气瓶装满水,倒立在盛水的水槽中 c.将导管从水槽中取出 d.加热,收集氧气 e.停止加热。则正确的操作顺序是(填序号)_____。
(7)用气焊的方法焊接某些金属时,常使用的乙炔气体,是由电石(固态)和水在常温下反应得到,已知乙炔密度比空气略小,难溶于水,则发生装置选上图中的_____,收集装置选_____.(填序号)。
(8)面四种途径都可以得到氧气:

①写出实验室中通过甲途径制取氧气的符号表达式:_____
②从实现原料和反应过程的绿色化考虑,你认为在中学化学实验室中,甲、乙、丙三种制取氧气的途径中,_____(填“甲”、“乙”或“丙”)途径更体现化学实验的绿色化追求。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
(应用研究)
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为_______。
(制备研究)
(2)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和
气体X,该反应的化学方程式为2NaNH3+N2O = NaN3+NaOH+X,实验室检验X
气体使用的试纸是湿润________。
(Na2CO3质量分数测定)
工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图装置(已知H2SO4溶液与NaN3,反应不生成气体)。
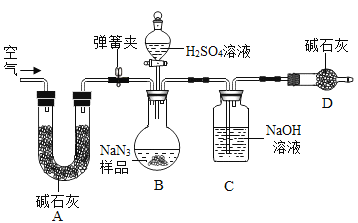
(3)装置A的作用是_____。设计的实验步骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置C;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,_______;⑤再次称量装置C。计算碳酸钠含量至少需要测定______(填数字)个数据。根据制备反应,分析工业级NaN3中含有Na2CO3的可能原因_______。
M |
(NaN3纯度测定)精确称量0.140 g NaN3样品,设计如图装置,测定其纯度。已知2 NaN3→ 3N2
(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。
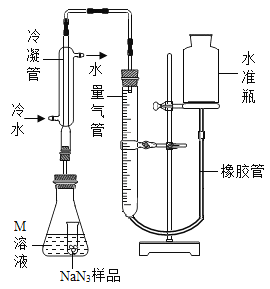
(4)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差_____(填“变大”、“变小”或“不变”),说明气密性良好。
(5)使小试管中的NaN3样品与M溶液接触的操作是______。
(6)使用冷水冷凝的目的是______。反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是_______。
(7)常温下测得量气管读数为67.2 mL(N2的密度为1.25 g/L),则实验中选用的量气管规格合适的是_____(填字母序号)。
A. 100 mL B. 1 L C. 2 L
(8)计算NaN3样品的纯度(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com