

| A. | 图1装置可以用来电解制氢气和氯气 | |
| B. | 图2装置可以完成“喷泉”实验 | |
| C. | 图3装置可以用来实验室制氯气 | |
| D. | 图4装置可以用来配制一定物质的量浓度的氯化钠溶液 |
分析 A.电解水应用惰性电极;
B.产生极大压强差的气体能发生喷泉实验;
C.浓盐酸与二氧化锰需要加热才反应;
D.读数时平视.
解答 解:A.电解水应用惰性电极,铜做阳极,铜失电子,氢氧根不放电,故A错误;
B.产生极大压强差的气体能发生喷泉实验,氯气极易和NaOH反应生成盐而产生极大压强差,从而形成喷泉实验,故B正确;
C.浓盐酸与二氧化锰需要加热才反应,不加热不反应,故C错误;
D.读数时平视,俯视体积偏小,故D错误.
故选B.
点评 本题考查化学实验方案评价,为高考高频点,侧重考查电解、喷泉实验、物质的制备以及溶液配制等,明确实验原理是解本题关键,从操作规范性、物质性质进行评价,题目难度不大.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯化硼是原子晶体 | |
| B. | 熔化时,氯化硼能导电 | |
| C. | 硼原子以sp3杂化 | |
| D. | 水解方程式:BCl3+3H2O═H3BO3+3HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂是为了加快反应速率,提高生产效率 | |
| B. | 向该体系中充入18O2,一段时间后18O只存在于SO3中 | |
| C. | 生成物的总能量大于反应物的总能量 | |
| D. | 将该反应设计成原电池,放出的热量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
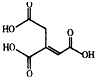
| A. | 化学式为C6H6O6 | |
| B. | 乌头酸能发生水解反应和加成反应 | |
| C. | 乌头酸能使酸性高锰酸钾溶液褪色 | |
| D. | 含1mol乌头酸的溶液最多可消耗3molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减压 | B. | 加压 | C. | 适当降温 | D. | 升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴水和淀粉溶液 | B. | AgNO3溶液和稀硝酸 | ||
| C. | CCl4溶液 | D. | 氯水和碘化钾淀粉溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾在水中能形成Al(OH)3胶体,可用作净水剂 | |
| B. | 金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 | |
| C. | 漂白粉、盐酸、碘酒和液氯都属于混合物 | |
| D. | 将SO2通人品红溶液,溶液褪色后加热恢复原色;将SO2通人溴水,溴水褪色后加热也能恢复原色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com