
����Ŀ���Ҵ��������г��������ʣ���;�㷺����ϳɷ���������Ҳ�����о���ֵ��
I��ֱ���Ҵ�ȼ�ϵ����DEFC�����кܶ��ŵ㣬���������ǵ��о���Ȥ���������������Ҵ�ȼ�ϵ�ء�
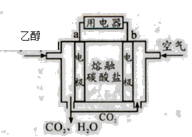
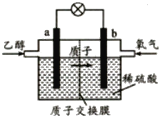
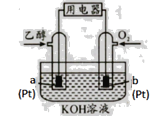
�����Ҵ�ȼ�ϵ�� �����Ҵ�ȼ�ϵ�� �������Ҵ�ȼ�ϵ��
��1�������Ҵ�ȼ�ϵ����������Ӧ���Ϊ____________��
��2�������Ҵ�ȼ�ϵ�������缫a�Ϸ����ĵ缫��ӦʽΪ________________________��ʹ�ÿ���������������ع��������м��Ի���½�����ԭ���� ____________��
��3�������Ҵ�ȼ�ϵ�������缫b�Ϸ����ĵ缫��ӦʽΪ_______________________��ͨ�����ӽ���Ĥ��������___________��
��4���������Ҵ�ȼ�ϵ������ѡ������̼���Ϊ���ʣ���ع���ʱ��CO32����缫____������a������b�����ƶ����缫b�Ϸ����ĵ缫��ӦʽΪ_____________________��
II����֪����ֱ��ˮ�Ϸ�������ȡ�Ҵ���H2O(g) + C2H4(g) ![]() CH3CH2OH(g)����n(H2O)�Un(C2H4)=1�U1ʱ����ϩ��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��
CH3CH2OH(g)����n(H2O)�Un(C2H4)=1�U1ʱ����ϩ��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��
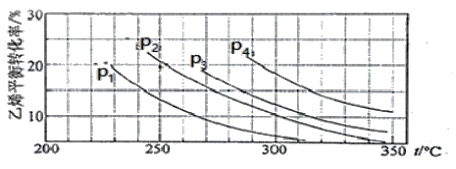
��1��ͼ��ѹǿP1��P2��P3��P4�Ĵ�С˳��Ϊ��_________________________�������ǣ�______________��
��2������ֱ��ˮ�Ϸ����õĹ�������Ϊ������/������Ϊ��������Ӧ�¶�290 ����ѹǿ6.9MPa��n(H2O)�Un(C2H4)=0.6�U1������������ϩ��ת����Ϊ5�G����Ҫ��һ�������ϩ��ת���ʣ����˿����ʵ��ı䷴Ӧ�¶Ⱥ�ѹǿ�⣬�����Բ�ȡ�Ĵ�ʩ��__________________________________��
���𰸡� ���� C2H5OH+16OH����12e��=CO32��+11H2O �����е�CO2����KOH��Һ��Ӧ��������Һ�ļ��ԣ�ͬʱ��Ӧ��Ҳ������KOH O2+12H+ +12e��6H2O H+ a O2+ 2CO2 +4e��=2CO32�� P4>P3>P2>P1 ��ӦΪ���������С�ķ�Ӧ������ѹǿƽ�������ƶ�����ϩ��ת��������������ͬ�����£�ת����Խ��Ĵ���ѹǿԽ�� ����H2O(g)�������Ƴ�������
���������� (1)ȼ�ϵ����ͨ��ȼ�ϵ�Ϊ������ͨ�������������Ϊ�����������Ҵ�ȼ�ϵ����������Ӧ���Ϊ������(2)�����Ҵ�ȼ�ϵ���У��缫aΪ�������缫��ӦʽΪC2H5OH+16OH����12e��=2CO32��+11H2O��ʹ�ÿ����������� �������е�CO2����KOH��Һ��Ӧ��������Һ�ļ��ԣ�ͬʱ��Ӧ��Ҳ������KOH���ʴ�Ϊ��C2H5OH+16OH����12e��=2CO32��+11H2O�������е�CO2����KOH��Һ��Ӧ��������Һ�ļ��ԣ�ͬʱ��Ӧ��Ҳ������KOH��(3)�����Ҵ�ȼ�ϵ���У��缫bΪ�������缫��ӦʽΪ3O2+12H+ +12e��= 6H2O��ͨ�����ӽ���Ĥ�ܹ�ʹ������H+��ͨ����(4)����ͼʾ��aΪ������ԭ��������������������ƶ���CO32����缫a�ƶ����缫bΪ�������缫��ӦʽΪO2+ 2CO2 +4e��= 2 CO32������ (1)����ͬ�¶���������ϩת����Ϊp1��p2��p3��p4����C2H4(g)+H2O(g)�TC2H5OH(g)��֪����ӦΪ���������С�ķ�Ӧ����������ѹǿ��ƽ�������ƶ�����ϩ��ת������ߣ����ѹǿ��ϵ��p1��p2��p3��p4���ʴ�Ϊ��p1��p2��p3��p4����ӦΪ���������С�ķ�Ӧ������ѹǿƽ�������ƶ�����ϩ��ת��������������ͬ�����£�ת����Խ��Ĵ���ѹǿԽ��(��)��Ҫ��һ�������ϩת���ʣ����˿����ʵ��ı䷴Ӧ�¶Ⱥ�ѹǿ�⣬�����Ըı����ʵ�Ũ�ȣ����ƽ����ϵ�н������Ҵ����������������ˮ������Ũ�ȣ��ı�������ʵ����ıȵȣ��ʴ�Ϊ���������Ҵ�Һ����ȥ������H2O(g)������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У����������ᷴӦ����������������Һ��Ӧ���ǣ� ��
A.AlCl3
B.Al��OH��3
C.Al2��SO4��3
D.NaAlO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ɻ��õ������������泥�NH4ClO4���Ļ����Ϊ����ȼ�ϣ���ȼʱ����������������������立�Ӧ���䷽��ʽ�ɱ�ʾΪ��2NH4ClO4 ![]() N2��+4H2O+Cl2��+2O2�����ų�����ΪQ�����жԴ˷�Ӧ�����д�����ǣ� ��
N2��+4H2O+Cl2��+2O2�����ų�����ΪQ�����жԴ˷�Ӧ�����д�����ǣ� ��
A.��Ӧ���ڷֽⷴӦ
B.������Ӧ˲������������������ƶ�����ɻ�����
C.��Ӧ�������仯��˵����Ҫ�ǻ�ѧ��ת��Ϊ���ܺͶ���
D.�ڷ�Ӧ�и������ֻ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������NF3����һ�����͵��Ӳ��ϣ����ڳ�ʪ�Ŀ�������ˮ�����ܷ���������ԭ��Ӧ���䷴Ӧ�IJ����У�HF��NO��HNO3 �� �����Ҫ��ش��������⣺
��1����Ӧ�����У��������뱻��ԭ��Ԫ��ԭ�ӵ����ʵ���֮��Ϊ ��
��2��д���÷�Ӧ�Ļ�ѧ����ʽ �� ����Ӧ������0.2mol HNO3 �� ת�Ƶĵ�����ĿΪ����
��3��NF3��һ����ɫ���������壬��һ��NF3�ڿ�����й©���������ڷ��֣����жϸ�����й©ʱ�������� ��
��4��һ��NF3й©��������NaOH��Һ���ܵķ���������Ⱦ��������NaNO2��NaF��H2O�⣬���϶������ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ����٤������������˵����ȷ���ǣ� �� 
A.��״���£�22.4L HF�к��з�ԭ����ĿΪNA
B.0.1mol/L��NH4HSO4��Һ�еμ�0.1mol/L��Ba��OH��2��Һ�������պ���ȫ��c��NH4+����c��OH������c��SO42������c��H+��
C.1mol ��ͼ������Ũ��ˮ��Ӧʱͨ���������Br2Ϊ6mol
D.12gʯīϩ������ʯī���к�����Ԫ���ĸ���Ϊ0.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������2mol/L��Na2CO3��Һ950mL������ʱӦѡ�õ�����ƿ�Ĺ��ͳ�ȡNa2CO3�������ֱ��ǰ�
A. 1000mL��212g B. 950mL��201.4g
C. ������572g D. 500mL��286g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�����ڹ�ũҵ����������Ӧ�ù㷺�������������⣮
��1������ͭ��Һʱ���������ж���һ�ֽⶾ����
P4+CuSO4+H2O��Cu3P+H3PO4+H2SO4 �� ��6molH3PO4���ɣ���CuSO4������P4�����ʵ���Ϊ ��
��2�����Ļ�����ϳɡ�Ӧ�ü����Ĺ̶�һֱ�ǿ�ѧ�о����ȵ㣮��CO2��NH3Ϊԭ�Ϻϳɻ������ص���Ҫ��Ӧ���£�
��2NH3��g��+CO2��g��=NH2CO2NH4��s������H=��159.47kJmol��1
��NH2CO2NH4��s��=CO ��NH2��2��s��+H2O��g������H=a kJmol��1
��2NH3��g��+CO2��g��=CO��NH2��2��s��+H2O��g������H=��86.98kJmol��1
��aΪ ��
��3����ͼ��ʾʹ�����͵缫���ϣ���N2��H2Ϊ�缫��Ӧ���HCl��NH4ClΪ�������Һ����������ṩ������ͬʱ����ʵ�ֵ��̶�������ȼ�ϵ�أ���д���õ�ص�������Ӧʽ �� �����пɷ����������A�Ļ�ѧʽΪ �� 
��4�������£���0.1mol/L��ˮ�м�������N2O5 �� ʹ��Һ��c��NH3H2O����c��NH4+��=5��9����ʱ��Һ��pH= �� ��25��ʱ��NH3H2O�ĵ��볣��Kb=1.8��10��5��
��5��SiO2��������������һ�ּ�ǿ�Ķ�Ԫ���ˮ��������������3��Ԫ����ɣ����з��������������Ϊ79.17%����д��SiO2�������������ӷ���ʽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ���ʵ��������и�������ȫȼ�պ��������������ǣ� ��
A.����
B.����
C.��ϩ
D.��Ȳ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ڴ��������
A. Ư�� B. ���ȼ� C. Һ�� D. Fe(OH)3����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com