
【题目】某学习小组为探究传统的Al—空气—海水电池,设计了如图所示的实验装置。该电池工作时,下列说法正确的是( )
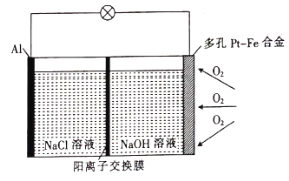
A.多孔Pt—Fe合金电极有利于吸附O2
B.负极的电极反应式为![]()
C.若反应中消耗5.4 g Al,则消耗3.36 L O2
D.当1 mol O2参与反应时,有4 mol阳离子通过阳离子交换膜
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中正确的是( )
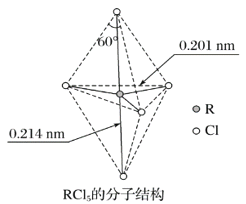
A. 每个原子都达到8电子稳定结构
B. 键角(Cl—R—Cl)有90°、120°、180°几种
C. RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子
D. 分子中5个R—Cl键键能不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为回收利用含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺。工艺流程如图:
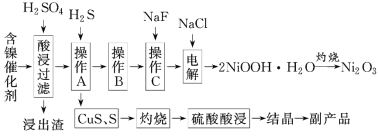
已知:①常温下有关氢氧化物开始沉淀和沉淀完全时的pH如下表所示:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.7 | 9.7 | 9.2 |
②Cu2O+2H+=Cu+Cu2++H2O
③常温时,Ksp(CaF2)=2.7×10-11
回答下列问题:
(1)写出酸浸时Fe2O3和硫酸反应的化学方程式:__。
(2)浸出渣主要成分为CaSO4·2H2O和__两种物质。
(3)操作B是除去滤液中的铁元素,某同学设计了如下方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH在3.7~7.7范围内,静置,过滤。请对该实验操作进行评价并说明理由:__(若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)流程中的“副产品”为__(填化学式)。在空气中灼烧CuS可以得到铜的氧化物,向Cu、Cu2O、CuO组成的混合物中加入1L0.6mol·L-1HNO3溶液恰好使混合物溶解,同时收集到2240mLNO气体(标准状况下),若该混合物中含0.1molCu,与稀硫酸充分反应至少消耗__molH2SO4。
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol·L-1,则溶液中![]() =__。
=__。
(6)电解产生2NiOOH·H2O的原理分两步:
①碱性条件下,Cl-在阳极被氧化为ClO-。生产1molClO-,消耗OH-__mol。
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀,则该步反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】流动电池可以在电池外部调节电解质溶液,从而维持电池内部电解质溶液浓度稳定,原理如图。下列说法错误的是
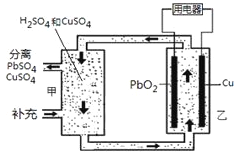
A.Cu为负极
B.PbO2电极的电极反应式为:PbO2+ 4H++ SO42-+ 2e-= PbSO4+ 2H2O
C.甲中应补充硫酸
D.当消耗1 mol PbO2,需分离出2 mol CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴与氢气在一定条件下反应的热化学方程式如下:
①Br2(g)+H2(g)2HBr(g) △H=-Q1kJ·mol-1
②Br2(l)+H2(g)2HBr(g) △H =-Q2kJ·mol-1
下列说法正确的是
A.Q1<Q2
B.1molHBr(g)具有的能量大于1molHBr(l)具有的能量
C.相同条件下,Cl2(g)+H2(g)2HCl(g) △H >-Q1kJ·mol-1
D.向1molBr2(g)中加入1molH2(g)在该条件下充分反应,放出Q1kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组利用如图所示装置比较浓、稀硝酸氧化性的强弱。

实验步骤如下:
Ⅰ.连接好装置,并检查装置的气密性;
Ⅱ.加入相应试剂,关闭弹簧夹,打开试管①,向其中加入适量的![]() 粉末,立即盖上橡皮塞;
粉末,立即盖上橡皮塞;
Ⅲ.将铜丝伸入浓硝酸中,观察现象;
Ⅳ.将铜丝提起,打开弹簧夹,再向装置①中通入一定量的CO2气体……
回答下列问题:
(1)检查该装置气密性的方法为____________________________________________________________。
(2)加入少量![]() 粉末的作用为________________________;通入一定量的CO2气体的作用为________________________。
粉末的作用为________________________;通入一定量的CO2气体的作用为________________________。
(3)将铜丝伸入浓硝酸中,立即观察到试管①中有红棕色气体生成,发生反应的化学方程式为_________________________;红棕色气体进入试管②中后变成无色,发生反应的化学方程式为______________________________,试管③液面上方无红棕色气体出现,试管④液面上方产生红棕色气体同时溶液出现黄色,则试管④中发生反应的化学方程式为______________________________,说明浓硝酸的氧化性强于稀硝酸。
(4)NO2与氢氧化钠溶液反应生成两种盐,其离子方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的有机产物中有且仅有一种结构的是
A.异戊二烯![]()
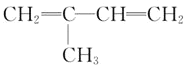
![]() 与等物质的量的
与等物质的量的![]() 发生加成反应
发生加成反应
B.2-氯丁烷(CH3CHClCH2CH3)与NaOH乙醇溶液共热发生消去HCl的反应
C.甲苯在一定条件下发生硝化生成一硝基甲苯的反应
D.邻羟基苯甲酸与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,欲实现下列有机物之间的转化,所选试剂正确的是( )
选项 | 物质转化 | 试剂 |
A |
| 足量酸性 |
B |
|
|
C |
| 浓硫酸和浓硝酸的混合溶液 |
D |
| 溴的四氯化碳溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别在三个容积均为2.0L的恒容密闭容器中发生反应:A(g)+B(g)D(g)。其中容器甲中反应进行至5min时达到平衡状态,相关实验数据如表所示:
容器 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | 化学平衡常数 | ||
n(A) | n(B) | n(D) | n(D) | |||
甲 | 500 | 4.0 | 4.0 | 0 | 3.2 | K1 |
乙 | 500 | 4.0 | a | 0 | 2.0 | K2 |
丙 | 600 | 2.0 | 2.0 | 2.0 | 2.8 | K3 |
下列说法不正确的是
A.0~5min内,甲容器中A的平均反应速率v(A)=0.64mol·L-1·min-1
B.a=2.2
C.若容器甲中起始投料为2.0molA、2.0molB,反应达到平衡时,A的转化率小于80%
D.K1=K2>K3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com