
| (W-m)g |
| 44g/mol |
| W-m |
| 44 |
| W-m |
| 44 |
| W-m |
| 44 |
| 53(W-m) |
| 22 |
| ||
| n |
| 53(W-m) |
| 22n |
| 53(W-m) |
| 22n |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 | B、3 | C、5 | D、7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
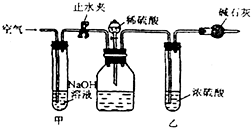
 在室温和大气压强下,用图示的装置进行实验,测得a g含CaC2 90%的样品与水完全反应产生的气体体积为b L.现欲在相同条件下,测定某电石试样中CaC2的质量分数,请回答下列问题:
在室温和大气压强下,用图示的装置进行实验,测得a g含CaC2 90%的样品与水完全反应产生的气体体积为b L.现欲在相同条件下,测定某电石试样中CaC2的质量分数,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 水① |
| ② |
| ③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com