
【题目】对于处于化学平衡状态的反应C(s)+H2O(g)![]() CO(g)+H2(g);ΔH>0,既要提高反应速率又要提高H2O的转化率,下列措施中可行的是
CO(g)+H2(g);ΔH>0,既要提高反应速率又要提高H2O的转化率,下列措施中可行的是
A. 增大H2O(g)的浓度 B. 升高温度
C. 降低压强 D. 增加碳的量
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】在元素周期表中,某些主族元素与右下方主族元素的有些性质是相似的,被称为“对角线”规则,如:Li和Mg、Be和Al、B和Si。下列说法不正确的是
A. Li在N2中燃烧生成Li3N B. LiOH是极易溶的强碱
C. Be(OH)2既能溶于强酸又能溶于强碱溶液 D. 硼酸钠溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1000mol·L-1 NaOH溶液滴定 20.00mL0.1000mol·L-1某一元酸HA溶液,滴定曲线如图。下列说法正确的是( )
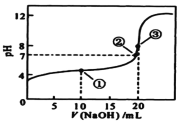
A. HA是强电解质
B. 点①所示溶液中:c(A-) >c(Na+)>c(H+) >c(OH-)
C. 点②所示溶液中:c(Na+) =c(HA) +c(A-)
D. 水的电离程度随着NaOH溶液的滴入,不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电池在我们的生活中有着重要的应用,请回答下列问题:
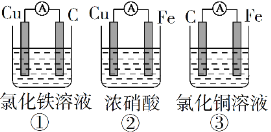
(1)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是______(填序号),写出正极的电极反应式_______。若构建原电池时两个电极的质量相等,当导线中通过0.05mol电子时,两个电极的质量差为________。
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
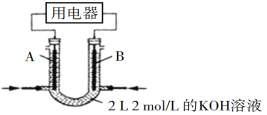
实验测得OH定问移向B电极,则_____(填“A”或“B”)处电极入口通甲烷,其电极反应式为___________。当消耗甲院的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素R、W、X、Y、Z的原子序数依次增大,R的简单氢化物可用作制冷剂,X是短周期中金属性最强的元素。Y的简单离子在同周期元素的简单离子中半径最小,由W、X和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀(Z的单质)析出,同时产生有刺激性气味的气体(Z的氧化物)。下列说法正确的是( )
A. 原子半径:Z>Y>X>W
B. Z的简单氢化物的热稳定性比W的强
C. Y的氧化物既可溶于R的最高价氧化物对应的水化物水溶液,也可溶于R的氢化物水溶液
D. X与W、Z形成的化合物不少于三种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化物有剧毒,我国工业废水中氰化物(CN-)的最高允许排放浓度为0.5 mg/L。对废水中CN-的处理方法是:在碱性条件下,用Cl2将废水中的CN-转化成N2和CO2等,使废水得到净化。发生的反应为2CN-+8OH-+5Cl2===2CO2+N2+10Cl-+4H2O。下列有关说法不正确的是( )
A. 上述反应中氧化产物有N2和CO2
B. 经测定,NaCN的水溶液呈碱性,说明CN-能促进水的电离
C. 若上述反应生成0.4 mol CO2,则溶液中阴离子增加的物质的量为2 mol
D. 现取1 L含CN-1.02 mg/L的废水,至少需用5.0×10-5 mol Cl2处理后才符合排放标准
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修5:有机化学基础)
化合物G是一种有机光电材料中间体。由A制备G的一种合成路线如下图所示:
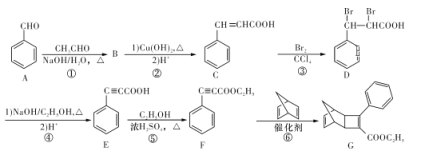
请回答下列问题:
(1)F中官能团的名称为___________。
(2)B的分子式为C9H8O,B→C的过程中第一步反应的化学方程式为_________________。
(3)反应②~⑥中属于取代反应的是___________(填序号)。
(4)在镍的催化作用下,E与足量的氢气加成所得的产物分子中有___________种不同环境的氢原子。
(5)一定条件下以F为单体发生加聚的反应方程式为___________。
(6)C有多种同分异构体,其中同时满足下列条件的同分异构体有_________种。
①能发生银镜反应;
②能发生水解反应;
③能与溴的CCl4溶液发生加成反应;
④属于芳香族化合物。
(7)请写出以![]() 和CH3C≡CH为原料制备
和CH3C≡CH为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干中合成路线)。____________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干中合成路线)。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,向V L密闭容器中加入0.5 mol NO和0.5 mol活性炭,发生反应:
2NO(g)+C(s)![]() N2(g)+CO2(g) △H= —Q kJ·mol-1(Q>0),达到平衡时的数据如下:
N2(g)+CO2(g) △H= —Q kJ·mol-1(Q>0),达到平衡时的数据如下:
温度/℃ | n (C)/mol | n(CO2)/mol |
T1 | 0.15 | |
T2 | 0.375 |
下列有关说法正确的是
A. 由上述信息可推知:T1 > T2
B. T2℃时,若反应达平衡后再缩小容器的体积,c (N2):c (NO)增大
C. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率增大
D. T1℃时,该反应的平衡常数![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com