
【题目】下列说法正确的是( )
A.熔融状态下硫酸氢钾中的离子键、共价键均被破坏,形成定向移动的离子,因而能够导电
B.F2、Cl2、Br2、I2的熔沸点逐渐升高,是因为分子间作用力越来越大
C.NH3和Cl2两种分子中,每个原子的最外层都达到8电子的稳定结构
D.HF、HCl、HBr、HI的稳定性逐渐减弱,沸点逐渐升高
【答案】B
【解析】
A.熔融状态下硫酸氢钾的电离方程式为![]() ,形成自由移动的离子,具有导电性,共价键不被破坏,故A错误;
,形成自由移动的离子,具有导电性,共价键不被破坏,故A错误;
B.组成和结构相似的物质,相对分子质量越大,范德华力越大,熔沸点越大,则F2、Cl2、Br2、I2的熔、沸点逐渐升高,是因为分子间作用力越来越大,故B正确;
C.NH3中H原子为2电子稳定结构,N原子为8电子稳定结构,Cl2分子中Cl原子的最外层具有8电子稳定结构,故C错误;
D.随着原子序数的增大,单质得电子能力逐渐减弱,其阴离子失电子能力逐渐增强,所以HF、HCl、HBr、HI稳定性逐渐减弱;组成和结构相似的物质,相对分子质量越大,范德华力越大,熔沸点越大,但HF分子间有氢键,所以HF、HCl、HBr、HI沸点最高的是HF,故D错误:
故选B。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】短周期元素A、B、D、E的原子序数依次增大,B、E位于同主族,四种元素的一种化合物的结构式如图所示。下列说法不正确的是
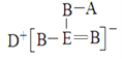
A.B的最简单氢化物的沸点比E的高
B.D和E形成的三核二元化合物的水溶液中,阴、阳离子的浓度之比小于1:2
C.化合物DA的水溶液呈碱性
D.同时含有A、B、D、E四种元素的盐至少有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C3N4晶体的硬度与金刚石相差不大,且原子间均以单键结合,下列关于C3N4的说法错误的是
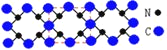
A.该晶体中碳原子和氮原子的最外层都满足8电子稳定结构
B.C3N4晶体中C-N键的键长比金刚石的C-C键的键长要长
C.C3N4晶体中每个C原子连接4个N原子,每个N原子连接3个C原子
D.该晶体与金刚石相似,都是原子间以共价键形成的空间网状结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,原理如图所示。下列说法不正确的是( )
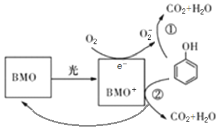
A.O2-不如O2结构稳定
B.①和②中被降解的苯酚的物质的量之比为1:1
C.降解产物的分子中只含有极性共价键
D.该过程的总反应:![]() +7O2
+7O2![]() 6CO2+3H2O
6CO2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是具有紫色光泽的粉末,是一种高效绿色强氧化剂,碱性条件下稳定,可用于废水和生活用水的处理。实验室以石墨和铁钉为电极,以不同浓度的NaOH溶液为电解质溶液,控制一定电压电解制备高铁酸钠,电解装置和现象如下:
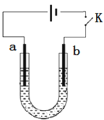
c(NaOH) | 阴极现象 | 阳极现象 |
1 mol·L-1 | 产生无色气体 | 产生无色气体,10min内溶液颜色无明显变化 |
10 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,3min后溶液变为浅紫红色,随后逐渐加深 |
15 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,1min后溶液变为浅紫红色,随后逐渐加深 |
下列说法正确的是( )
A.a为石墨,b为铁钉
B.阴极主要发生反应 4OH--4e-== O2↑+ 2H2O
C.高浓度的NaOH溶液,有利于发生Fe-6e-+ 8OH-== FeO42-+ 4H2O
D.制备Na2FeO4时,若用饱和NaCl溶液,可有效避免阳极产生气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. HClO、H2CO3、HNO3、HClO4的酸性依次增强
B. 苹果酸![]() 含有1个手性碳原子
含有1个手性碳原子
C. HCl、NH3、C2H5OH均易溶于水的原因之一是与H2O分子均形成氢键
D. 以极性键结合的分子不一定是极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据反应2NaIO3+5SO2+4H2O=I2+3H2SO4+2NaHSO4,并利用下列装置从含NaIO3的废液中制取单质碘的CCl4溶液并回收NaHSO4。

其中装置正确且能达到实验目的的组合是( )
A.①②③④B.①②③
C.②④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求填空:
(1)C、N元素形成的新材料具有如图所示的结构该晶体的化学式为________________。
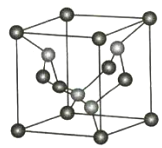
![]() C(位于顶点和面心)
C(位于顶点和面心)![]() N
N
(2)氮化碳和氮化硅晶体结构相似,是新型的非金属高温陶瓷材料,它们的硬度大、熔点高、化学性质稳定。
①氮化硅的硬度________(填“大于”或“小于”)氮化碳的硬度,原因是___________________________。
②已知氮化硅的晶体结构中,原子间都以单键相连,且氮原子与氮原子不直接相连、硅原子与硅原子不直接相连,同时每个原子都满足最外层8电子稳定结构,请写出氮化硅的化学式:______________。
(3)第ⅢA、VA元素组成的化合物GaN、GaP、CaAs等是人工合成的新型半导体材料,其晶体结构与晶体硅相似。在GaN晶体中,每个Ga原子与________个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为________。在四大晶体类型中,GaN属于________晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中发生反应:2NO2(g)![]() N2O4(g) ΔH=-a kJ/mol(a>0),设NA为阿伏加德罗常数的值。下列说法错误的是( )
N2O4(g) ΔH=-a kJ/mol(a>0),设NA为阿伏加德罗常数的值。下列说法错误的是( )
A.平衡后升高温度,容器中气体颜色加深
B.每消耗44.8 LNO2,生成N2O4的分子数一定为NA
C.该容器中气体质量为46 g时,原子总数为3NA
D.若N2O4分子数增加0.5NA,则放出0.5a kJ的热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com