
| A. | Ca2+.Cl-.HCO3-.K+ | B. | Na+.Al3+.Cl-.SO42- | ||
| C. | NH4+.SO32-.Na+ NO3- | D. | Na+.SO42-.[Al(OH)4]-.OH- |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 19世纪初,化学家维勒提出了有机化学的概念 | |
| B. | 自然界存在或不存在的有机物都可以利用人工合成出来 | |
| C. | 有机化合物的定量分析法最早由瑞典化学家贝采里乌斯提出的 | |
| D. | 著名的有机合成化学家李比希曾说:“有机合成的威力体现为在老的自然界旁边再建立起一个新的自然界.” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋鉴别食盐和纯碱 | |
| B. | 用丁达尔效应现象鉴别蛋白质溶液和蔗糖溶液 | |
| C. | 用Ca(OH)2溶液鉴别SO2、CO2气体 | |
| D. | 用硝酸银溶液鉴别溴蒸气和二氧化氮气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn的电子排布式:1s22s22p63s23p64s2 | |
| B. | Fe2+的原子结构示意图: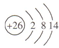 | |
| C. | C的价电子轨道表示式: | |
| D. | HClO的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮元素可形成丰富多彩的物质.
氮元素可形成丰富多彩的物质.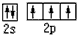 ;等物质的量的NH3和N2混合气体中σ键与π键的数目之比为2:1.
;等物质的量的NH3和N2混合气体中σ键与π键的数目之比为2:1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ca(ClO)2溶液中通入少量SO2:Ca2++3ClO-+SO2+H2O═CaSO3↓+Cl-+2HClO | |
| B. | 1 mol/L的NaAlO2溶液和2.5 mol/L的盐酸等体积均匀混合:2AlO2-+5H+═Al(OH)3↓+Al3++H2O | |
| C. | 将11.2L标准状况下的氯气通入200mL2mol/L的FeBr2溶液中,离子反应方程式为:2Fe2++8Br-+5Cl2═2Fe3++4Br2+10Cl- | |
| D. | 氢氧化亚铁溶于稀硝酸中:Fe(OH)2+2H+═Fe2++2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com