
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中: Fe3+、Mg2+、SCN 、Cl
B.![]() =1×10-12的溶液中:K+、Na+、CO32、NO3
=1×10-12的溶液中:K+、Na+、CO32、NO3
C.![]() 的溶液中: K+、NH4+、MnO4、SO42-
的溶液中: K+、NH4+、MnO4、SO42-
D.能使甲基橙变红的溶液中: Na+、NH4+、SO42-、HCO3-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2 ,则下列说法中正确的是( )
2KClO3 + H2C2O4 + H2SO4 ![]() 2ClO2↑ + K2SO4 + 2CO2↑ + 2H2O
2ClO2↑ + K2SO4 + 2CO2↑ + 2H2O
A. KClO3在反应中是还原剂
B. 1molKClO3参加反应,在标准状况下能得到22.4L气体
C. 在反应中H2C2O4 既不是氧化剂也不是还原剂
D. 1molKClO3参加反应有1mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 天然气和沼气的主要成分都是甲烷,它们都属于不可再生能源
B. 煤的气化和液化均属于物理变化
C. 石油裂解的目的是为了得到更多的汽油
D. 用含糖类、淀粉比较多的农作物为原料,在催化剂作用下,经水解和细菌发酵制乙醇的过程属于生物质能的利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反-2-己烯醛(D)是一种重要的合成香料,下列合成路线是制备D的方法之一。根据该合成路线回答下列问题:
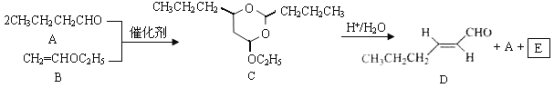
已知: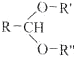
![]() RCHO+R'OH+R"OH
RCHO+R'OH+R"OH
(1)A的名称是__________;B分子中共面原子数目最多为__________;C分子中与环相连的三个基团中,不同化学环境的氢原子共有__________种。
(2)D中含氧官能团的名称是__________,写出检验该官能团的化学反应方程式:__________。
(3)E为有机物,能发生的反应有__________。
a.聚合反应b.加成反应c.消去反应d.取代反应
(4)B的同分异构体F与B有完全相同的官能团,写出F所有可能的结构:________。
(5)以D为主要原料制备己醛(目标化合物),在方框中将合成路线的后半部分补充完整。
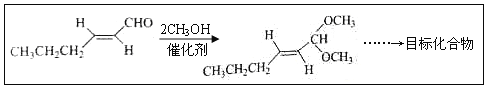
(6)问题(5)的合成路线中第一步反应的目的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁钉在氯气中被锈蚀为棕黄色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液。则在Cl2、Cl-、H+中,具有氧化性的是__,其中氧化性最强的是___。
(2)盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性。现有如下三个反应,请写出盐酸在三个反应中,分别起何种作用:
①Zn+2HCl=ZnCl2+H2↑__;
②2HCl![]() H2↑+Cl2↑__。
H2↑+Cl2↑__。
(3)化学实验中,如使其步骤中的有害产物作为另一步骤的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如图中:
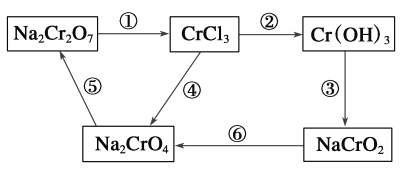
①在上述有编号的步骤中,需用还原剂的是__,需用氧化剂的是___。(填编号)
②完成步骤①的化学方程式,标出电子转移的方向和数目:
Na2Cr2O7+6KI+14HCl=2CrCl3+2NaCl+6KCl+3I2+___。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空题。
(1)47.5g某二价金属的氯化物中含有1molCl-,则该金属氯化物的摩尔质量为_______ ;该金属的相对原子质量为_______ 。
(2)标准状况下,3.4g NH3 的体积为_______ ;它与标准状况下_______ L H2S含有相同数目的氢原子。
(3)已知CO、CO2混合气体的质量共10.0g,在标准状况下的体积为6.72L,则混合气体中CO的质量为_______ ;CO2在相同状况下的体积为_______ 。
(4)将4g NaOH 溶解在10mL水中,再稀释成1L,从中取出10mL,这10mL溶液的物质 的量浓度为_______。
(5)已知ag氢气中含有b个氢原子,则阿伏加德罗常数的值可表示为 _______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性。回答下列问题。
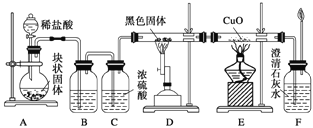
(1)写出装置A中发生反应的化学反应方程式:_______________________。
(2)装置B中最适宜的试剂是:_________________________。
(3)装置D中黑色固体为_____________(填名称),反应的化学方程式为:_____________________________。
(4)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是: ___________________________________。
(5)按照如图装置进行实验时,首先进行的操作名称是_____________。
(6)根据实验中的_________________现象,可证明CO具有还原性,有关反应的化学方程式是___________________________。
(7)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置________与________之间连接下图中的___________装置(填序号)。
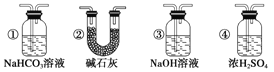
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和KHSO3能发生反应:ClO3-+HSO3-→SO42-+ Cl-+ H+(未配平)。已知该反应的速率随c(H+)的增大而加快。下图为用ClO3-在单位时间内物质的量浓度变化表示的该反应υ-t图。下列说法正确的
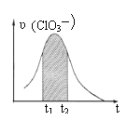
A. 反应开始时速率增大可能是c(H+)所致
B. 纵坐标为υ(Cl-)的υ-t曲线与图中曲线不能完全重合
C. 后期速率υ下降的主要原因是反应向逆反应方向进行
D. 图中阴影“面积”可以表示t1-t2时间内c(SO42-)增加量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减少环境污染,又能充分利用化学能,装置如图所示。下列说法正确的是( )

A.电流从电极A经过负载后流向电极B
B.为使电池持续放电,离子交换膜只允许阴离子通过
C.电极A的电极反应式为:2NH3-6e-=N2+6H+
D.室温下,当有4.48LNO2被处理时,转移电子为0.8mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com