
【题目】铜制印刷电路板蚀刻液的选择及再生回收是研究热点。
(1)用HCl-FeCl3溶液作蚀刻液
①该溶液蚀刻铜板时发生主要反应的离子方程式为__________.
②从废液中可回收铜井使蚀刻液再生。再生所用的试剂有Fe和______(填化学式)。
(2)用HCl-CuCl2溶液作蚀刻液蚀刻铜后的废液中含Cu+ 用下图所示方法可使蚀刻液再生并回收金属铜。
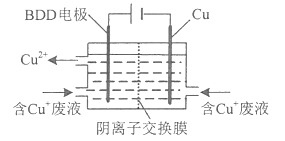
第一步BDD电极上生成强氧化性的氢氧自由基(HO·):H2O-e-==HO·+H+: .
第二步HO·氧化Cu+实现CuCl蚀刻液再生:________(填离子方程式) .
(3)用碱性CuCl2溶液(用NH3·H2O-NH4Cl调节pH)作蚀刻液
原理为:CuCl2+ 4NH3·H2O==Cu(NH3)4Cl2+ 4H2O;Cu(NH3)4Cl2+Cu== 2Cu(NH3)2Cl
①过程中只须及时补充NH3·H2O和NH4Cl就可以使蚀刻液再生,保持蚀刻能力。蚀刻液再生过程中作氧化剂的是_________(填化学式) 。
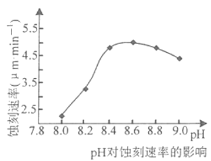
②50℃,c(CuCl2)=2.5mol·L-1, pH对蚀刻速串的影响如图所示。适宜pH约为8.3~9.0,pH过小或过大,蚀刻速率均会减小的原因是______________.
【答案】2Fe3++Cu=2Fe2++Cu2+ HCl和Cl2(或H2O2) H++Cu++·OH=Cu2++H2O O2 pH太低,NH3·H2O浓度小。Cu2+和生成Cu+不能形成对应的配合物,pH太高,Cu2+或Cu+会转化为难溶性碱(碱式盐)
【解析】
(1)①Fe3+与铜发生氧化还原反应生成亚铁离子和铜离子;
②需要将亚铁离子氧化生成铁离子,且在盐酸溶液中进行再生蚀刻液,防止铁离子的水解;
(2)阳极产生强氧化性的·OH ,将Cu+氧化生成Cu2+,Cl-通过阴离子交换膜进入阳极区可生成CuCl2蚀刻液;
(3)①蚀刻液再生过程中作氧化剂的是氧气;
②pH太低,NH3·H2O浓度小;Cu2+和生成Cu+不能形成对应的配合物,pH太高,Cu2+或Cu+会转化为难溶性碱(碱式盐)。
(1)①Fe3+与铜板发生氧化还原反应,其离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
②需要将亚铁离子氧化生成铁离子,且在盐酸溶液中进行再生蚀刻液,防止铁离子的水解,所以再生所用的试剂有除了Fe,还用HCl和Cl2(或H2O2),故答案为:HCl和Cl2(或H2O2);
(2)由图可知,阳极产生强氧化性的·OH ,在阳极上发生:H++Cu++·OH=Cu2++H2O,Cl-通过阴离子交换膜进入阳极区可生成CuCl2蚀刻液,故答案为:H++Cu++·OH=Cu2++H2O;
(3) ①蚀刻液再生过程中作氧化剂的是氧气,故答案为:O2;
②pH太低,NH3·H2O浓度小;Cu2+和生成Cu+不能形成对应的配合物,pH太高,Cu2+或Cu+会转化为难溶性碱(碱式盐),故答案为:
pH太低,NH3·H2O浓度小。Cu2+和生成Cu+不能形成对应的配合物,pH太高,Cu2+或Cu+会转化为难溶性碱(碱式盐)。


科目:高中化学 来源: 题型:
【题目】下列各组离子在给定条件下一定能大量共存的是
A.强酸性溶液中:H+、NO![]() 、SO
、SO![]()
B.pH=12的溶液中:OH-、K+、Cl-、HCO![]()
C.加入铝粉能放出氢气的溶液中一定存在:NH![]() 、NO
、NO![]() 、AlO
、AlO![]() 、SO
、SO![]()
D.25C时pH=7的无色溶液中:Na+、Cl-、SO![]() 、K+
、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.铜溶于氯化铁浓溶液中:Cu + Fe3+=Cu2+ + Fe2+
B.NH4HCO3溶液中加入过量氢氧化钠稀溶液:NH![]() + OH- =NH3·H2O
+ OH- =NH3·H2O
C.碳酸银溶于稀硝酸:Ag2CO3 + 2H+ =2Ag++ CO2↑+ H2O
D.铝粉投入到NaOH溶液中:2Al+2OH-=2AlO![]() +H2↑
+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.钠与水反应:Na+H2O==Na++OH-+H2↑
B.向AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=![]() +4
+4![]() +2H2O
+2H2O
C.FeCl3溶液净水原理:Fe3++3H2O=Fe(OH)3↓+3H+
D.用饱和Na2CO3溶液处理重晶石:BaSO4+![]() -==BaCO3+
-==BaCO3+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3个初始温度均为T℃的密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g) (正反应放热)。下列说法正确的是( )
2SO3(g) (正反应放热)。下列说法正确的是( )
容器编号 | 容器类型 | 初始体积 | 起始物质的量/mol | 平衡时SO3物质的量/mol | ||
SO2 | O2 | SO3 | ||||
I | 恒温恒容 | 1.0 L | 2 | 1 | 0 | 1.6 |
II | 绝热恒容 | 1.0 L | 2 | 1 | 0 | a |
III | 恒温恒压 | 0.5 L | 0 | 0 | 1 | b |
A.a>1.6
B.b<0.8
C.平衡时v正(SO2):v(I)<v(II)
D.若起始时向容器I中充入1.0 mol SO2(g)、0.20 mol O2(g)和4.0 mol SO3(g),则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.向NH4HSO4溶液中滴加NaOH溶液至水的电离程度最大:2OH-+NH4++H+=NH3·H2O+H2O
B.硫酸型酸雨久置,pH减小:![]()
C.将Cl2通入少量FeBr2溶液中:2Fe2++Cl2=2Fe3++2Cl-
D.4mol·L-1的NaAlO2溶液和7mol·L-1的盐酸等体积混合:![]() +7H++H2O=3Al(OH)3↓+Al3+
+7H++H2O=3Al(OH)3↓+Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时用0.05mol·L-1氨水滴定20mL0.05mol·L-1的叠氮酸(HN3)溶液,滴定过程中混合溶液的电阻率变化情况如图所示,已知NH3·H2O的电离常数Kb=1.7×10-5,HN3的电离常数Ka=1.9×10-5.下列说法中错误的是
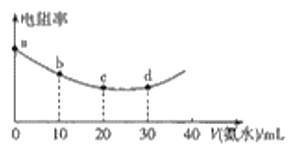
A.电阻率与离子浓度和离子所带电荷有关
B.a、b、c、d四点中,水的电离程度最大的是c
C.c~d之间可能存在:c(N3-)=c(NH4+)>c(H+)=c(OH-)
D.若用0.05mol·L-1HN3溶液滴定20mL0.05mol·L-1氨水,则所得曲线完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁的电化学腐蚀原理如图所示,下列有关说法中错误的是( )
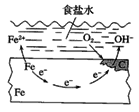
A. 铁片里的铁和碳与食盐水形成无数的微小原电池
B. 铁电极发生氧化反应
C. 负极的电极反应方程式为O2+4e-+2H2O=4OH-
D. 放置一段时间后,铁片上有铁锈出现
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com