
| A、Ba(OH)2溶液中滴加足量硫酸溶液:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| B、氢氧化钡溶液中滴加少量硫酸溶液:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| C、氢氧化钡溶液中滴加足量NaHSO4溶液:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| D、氢氧化钡溶液中滴加少量NaHSO4溶液:Ba2++OH-+H++SO42-=BaSO4↓+2H2O |


科目:高中化学 来源: 题型:
| A、标准状况下,4.48L H2O中所含的原子总数为0.6NA |
| B、常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
| C、通常状况下,NA 个CO2分子占有的体积为22.4L |
| D、物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在Ba(OH)2溶液中加入少量NaHCO3溶液:Ba2++OH-+HCO3-═BaCO3↓+H2O |
| B、AgNO3溶液中加入铜片:Cu+Ag+═Cu2++Ag |
| C、CaCO3溶于硝酸溶液中:CO32-+2H+═H2O+CO2↑ |
| D、Ba(OH)2溶液与稀H2SO4反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、固体NaCl不导电,所以NaCl是非电解质 |
| B、NH3、CO2的水溶液的导电,所以NH3、CO2是电解质 |
| C、铜、石墨均能导电,所以它们都是电解质 |
| D、蔗糖在水溶液中或熔融时均不导电,所以是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述三个反应都有单质生成,所以都是置换反应 |
| B、氧化性由强到弱的顺序是KBrO3>KClO3>Cl2>Br2 |
| C、反应②中还原剂与氧化剂的物质的量之比为6:1 |
| D、反应③中1mol还原剂参加反应时氧化剂得到电子的物质的量为2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
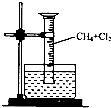 某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验.请回答有关问题:
某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验.请回答有关问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com