
| A. | 溶质的质量分数为ω=$\frac{a}{Vρ-a}$×100% | |
| B. | 溶质的物质的量浓度c=$\frac{1000a}{17V}$mol•L-1 | |
| C. | 溶液中c (OH-)=$\frac{b}{V}$mol•L-1 | |
| D. | 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω |
分析 A.根据m=ρV计算溶液的质量,氨水溶液溶质为氨气,根据溶质的溶质的质量分数=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%进行计算;
B.根据n=$\frac{m}{M}$计算a g NH3的物质的量,溶液体积为VmL,再根据c=$\frac{n}{V}$计算溶液的物质的量浓度;
C.根据溶液呈电中性,可知c(OH-)=c(H+)+c(NH4+),据此计算判断;
D.溶质氨气的质量不变,水的密度比氨水的密度大,等体积混合后溶液的质量大于原氨水的2倍,根据溶质的质量分数=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%判断.
解答 解:A.氨水溶液溶质为氨气,该溶液的密度为ρ g•cm-3,体积为VmL,所以溶液质量为ρVg,溶质氨气的质量为ag,溶质的质量分数ω=$\frac{ag}{ρVg}$×100%,故A错误;
B.a g NH3的物质的量为$\frac{ag}{17g/mol}$=$\frac{a}{17}$mol,溶液体积为VmL,所以溶液的物质的量浓度c=$\frac{\frac{a}{17}mol}{V×1{0}^{-3}L}$=$\frac{1000a}{17V}$mol/L,故B正确;
C.溶液中c(NH4+)=$\frac{bmol}{V×1{0}^{-3}VL}$=$\frac{1000b}{V}$mol/L,根据溶液呈电中性,可知c(OH-)=c(H+)+c(NH4+),则溶液中c(OH-)=$\frac{1000b}{V}$mol/L+c(H+),故C错误;
D.水的密度比氨水的密度大,相等体积的氨水与水,水的质量大,等体积混合后溶液的质量大于原氨水的2倍,溶液中氨气的质量相同,根据溶质的质量分数=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%可知,等体积混合所得溶液溶质的质量分数小于0.5ω,故D错误;
故选B.
点评 本题考查物质的量与其浓度、气体摩尔体积的综合应用,题目难度中等,注意氨水溶液中溶质以氨气计算,注意对公式的理解,C选项为易错点,学生容易忽略水电离产生的氢氧根离子.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 升高温度,气体颜色加深,则此反应为吸热反应 | |
| B. | 慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅 | |
| C. | 慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍 | |
| D. | 恒温恒容时,充入NO2气体,平衡向右移动,NO2的转化率增大,混合气体的颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | O2是氧化剂,Fe2+和S2O32-是还原剂 | |
| B. | 每生成1molFe3O4,则转移电子数为2mol | |
| C. | 参加反应的氧化剂与还原剂的物质的量之比为1:1 | |
| D. | 若有2molFe2+被氧化,则被Fe2+还原的O2为0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4L N2含有的分子数为NA | |
| B. | 1mol•L-1 Al2(SO4)3溶液中含SO42-数目为3NA | |
| C. | 常温常压下,46g NO2含有氧原子数为2NA | |
| D. | 1mol Fe在足量Cl2中燃烧,转移电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 事实 | 推论 |
| A | 与冷水反应,Na比Mg剧烈 | 金属性:Na>Mg |
| B | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca>Mg |
| C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S>C |
| D | HCl热稳定性比H2S强 | 非金属性:Cl>S |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
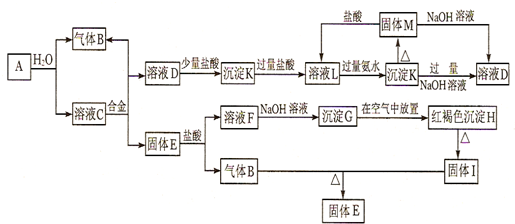
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
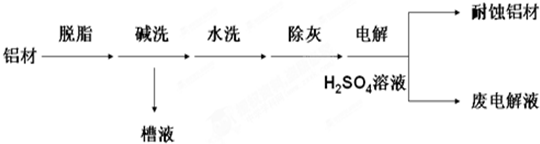
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将5 mL 0.02 mol/L的H2SO4溶液与5 mL 0.02 mol/L NaOH溶液充分混合,若混合后溶液的体积为10 mL,则混合液的pH=2 | |
| B. | 某物质的溶液中由水电离的c(H+)=1×10-amol/L,若a>7,则pH一定为14-a | |
| C. | pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液中,c(Na+)大小关系:①>③>② | |
| D. | CH3COONa溶液中加入少量KNO3固体后的碱性溶液一定有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com