
【题目】高锰酸钾溶液常用于物质的定性检验与定量分析。
(1)实验室里欲用KMnO4固体来配制250.00 mL 0.1000 molL-1的KMnO4酸性溶液。
①需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、____________。
②下列操作对实验结果的影响偏高的是____________(填序号)。
a.加水定容时俯视刻度线
b.未洗涤溶解后的烧杯和玻璃棒
c.颠倒摇匀后发现凹液面低于刻度线,没有加水补到刻度线
(2)用上述酸性KMnO4溶液来测定FeSO4溶液中Fe2+的物质的量浓度。原理如下:FeSO4 + KMnO4 + H2SO4 — K2SO4 + MnSO4 + Fe2(SO4)3 + H2O (未配平),实验时应测定的数据有:量取FeSO4溶液的体积和_____________。
(3)维生素C的水溶液能使高锰酸钾溶液褪色,根据这一原理,常用高锰酸钾测定蔬菜或水果中的维生素C的含量。上述实验原理体现了维生素C具有_________。(填氧化性、还原性)
【答案】250ml容量瓶 a 消耗的(滴定用去)的高锰酸钾溶液的体积 还原性
【解析】
根据题中高锰酸钾溶液常用于物质的定性检验与定量分析可知,本题考查配置溶液所需仪器、误差分析、滴定操作,运用配置溶液各步骤所需仪器、![]() ,滴定操作步骤分析。
,滴定操作步骤分析。
(1)①根据配制一定物质的量浓度的溶液的步骤是计算、称量、溶解、移液、洗涤、定容、摇匀可知需要的仪器有:天平、药匙、烧杯、玻璃棒、胶头滴管和250mL的容量瓶,
故答案为:250mL的容量瓶;
②a.加水定容时俯视刻度线,会导致溶液体积偏小,则浓度偏高,a项正确;
b. 未洗涤溶解后的烧杯和玻璃棒, 会导致溶液质量偏小,则浓度偏低,b项错误;
c. 颠倒摇匀后发现凹液面低于刻度线是正常的,不影响实验结果,c项错误。
故答案为:a;
(2)根据反应可知,用上述0.10000mol/L的酸性KMnO4溶液来测定FeSO4溶液中Fe2+的物质的量浓度的计算关系式为:C(Fe2+)·V(Fe2+)=5C(MnO4-)·V(MnO4-),由此可知要想求出C(Fe2+),只需知道量取的FeSO4溶液的体积和测出消耗掉的KMnO溶液的体积即可带入式子计算出C(Fe2+);
故答案为:消耗的(滴定用去)的高锰酸钾溶液的体积;
(3)维生素C的水溶液能使高锰酸钾溶液褪色,高锰酸钾溶液在反应中体现强氧化性,因此维生素体现还原性。
故答案为:还原性。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.一个CsCl晶胞中含有8个Cl-。
B.离子晶体类的物质均是电解质,故离子晶体均能导电。
C.锗和碳都存在具有原子晶体结构的单质,锗和碳都易形成四个键,能形成原子晶体结构。
D.某物质是由X(黑球)、Y(白球)两种微粒构成的,它们在二维平面中的排列情况为![]() ,则该物质化学式为XY2。
,则该物质化学式为XY2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组物质:①C60、C70、金刚石、石墨; ②苯甲醇、对甲基苯酚、邻甲基苯酚、间甲基苯酚;③126C、136C、146C;④HOCH2CHO、HOCH2CH2CHO、HOCH2CH2CH2CHO;⑤新戊烷、2,2-二甲基丙烷; ⑥甲醇、乙二醇、丙三醇。属于同位素的是_________、属于同系物的是_________、属于同分异构体的是_________、属于同素异形体的是_________、属于同种物质的的是_________。(填数字序号)
(2)苯的同系物中,有的侧链能被酸性高锰酸钾溶液氧化,生成芳香酸,反应如下:
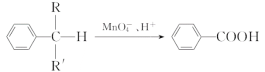 (R、R′表示烷基或氢原子)。
(R、R′表示烷基或氢原子)。
现有苯的同系物甲、乙、丙,分子式都是C10H14。甲不能被酸性高锰酸钾溶液氧化为芳香酸,它的结构简式是________;乙能被酸性高锰酸钾溶液氧化为分子式为C8H6O4的芳香酸,则乙可能的结构有________种。丙的苯环上的一溴代物只有一种。试写出四种丙的结构简式______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(简称PFS或聚铁)是水处理中重要的絮凝剂。以黄铁矿的烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制取聚合硫酸铁(![]() )的工艺流程如下:
)的工艺流程如下:
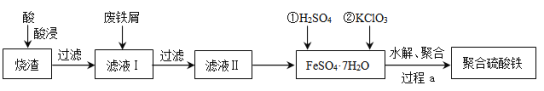
(1)酸浸时最合适的酸是_____(写化学式)。
(2)酸浸后溶液中主要的阳离子有_____。
(3)加入KClO3的目的是_____________________________(结合离子方程式说明)。
(4)过程a中生成聚合硫酸铁的过程是先水解再聚合。将下列水解反应原理的化学方程式补充完整。
_____Fe2(SO4)3+_____H2O![]() ______Fe2(OH)x(SO4)3-
______Fe2(OH)x(SO4)3-![]() + _____ ______
+ _____ ______
(5)过程a中水解要严控pH的范围。pH偏小或偏大聚合硫酸铁的产率都会降低,请解释原因__________。
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,通常盐基度越高,絮凝效果越好。盐基度B的表达式:![]() (n为物质的量)。为测量聚合硫酸铁的盐基度,进行如下实验操作:
(n为物质的量)。为测量聚合硫酸铁的盐基度,进行如下实验操作:
ⅰ.取聚合硫酸铁样品m g,加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,再加入KF溶液屏蔽Fe3+,使Fe3+不与OH-反应。然后以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V mL。
ⅱ.做空白对照实验,取与步骤ⅰ等体积等浓度的盐酸,以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V0 mL。
①该聚合硫酸铁样品中n(OH-) =_________mol。
②已知该样品中Fe的质量分数w,则盐基度B=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铜都是日常生活中常见的金属,有着广泛的用途。请回答下列问题:
(1)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于__________(填晶体类型);Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_____________;![]() 的核外电子排布式为_____________________。
的核外电子排布式为_____________________。
(2)![]() 溶液可用于检验_________(填离子符号);
溶液可用于检验_________(填离子符号);![]() 中碳原子杂化轨道类型为_____;1mol
中碳原子杂化轨道类型为_____;1mol![]() 含有的π键数目为_______(用N表示);C、N、O第一电离能由大到小的顺序为_________(用元素符号表示)。
含有的π键数目为_______(用N表示);C、N、O第一电离能由大到小的顺序为_________(用元素符号表示)。
(3)某M原子的外围电子排布式为![]() ,铜与M形成的某化合物的晶胞结构如下图所示(黑点代表铜原子)。
,铜与M形成的某化合物的晶胞结构如下图所示(黑点代表铜原子)。
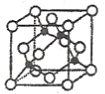
①该晶体的化学式为__________________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于___________(填“离子”或“共价”)化合物。
③已知该晶体的密度为![]() ,阿伏加德罗常数为
,阿伏加德罗常数为![]() ,则该晶体中铜原子和M原子之间的最短距离为____________________pm(只需写出计算式)。
,则该晶体中铜原子和M原子之间的最短距离为____________________pm(只需写出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T1、T2两种温度下BaSO4在水中的沉淀溶解平衡曲线如图所示,请回答下列问题:

(1)T1____(填“>”“<”或“=”)T2,T2时Ksp(BaSO4)=______。
(2)根据T1温度时BaSO4的沉淀溶解平衡曲线,判断下列说法正确的是____(填序号)。
A.加入Na2SO4可由a点变为b点
B.在T1曲线上方区域(不含曲线)的任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能由d点变为T1曲线上a、b之间的某一点(不含a、b)
D.升温可由b点变为d点
(3)沉淀的生成、溶解和转化在无机物制备和提纯及科研等领域有着广泛应用。已知25 ℃时,Ksp(BaSO4)=1×10-10。
①医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸的酸性较强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于胃酸的原因是________(用沉淀溶解平衡原理解释)。万一误服了少量BaCl2,应尽快用大量0.5 mol/L Na2SO4溶液洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为____ mol/L。
②长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。CaSO4转化为CaCO3的离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,物质X可转化为Y,也可转化为Z,转化过程中的能量变化如图所示。下列说法正确的是( )
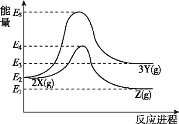
A.由2X→3Y的反应是放热反应
B.X、Y、Z三种物质中最不稳定的是Z
C.反应物总键能大于Z物质的总键能
D.若Y可转化为Z,则相应的反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同条件下,分别测得反应2SO2(g)+O2(g)![]() 2SO3(g)的化学反应速率,其中表示该反应进行得最快的是( )
2SO3(g)的化学反应速率,其中表示该反应进行得最快的是( )
A. υ(SO2)=4 mol·L-1·min-1B. υ(O2)=3 mol·L-1·min-1
C. υ(SO2)=0.1 mol·L-1·s-1D. υ(O2)=0.1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的是( )
A.a g Cl2中有b个氯原子,则阿伏加德罗常数NA的数值可表示为71b/a
B.5.6 g CO和22.4 L CO2中含有的碳原子数一定相等
C.将20 g NaOH固体溶解在500 mL水中所得溶液的物质的量浓度为1 mol·L-1
D.现有等物质的量的CO和CO2,这两种气体中氧原子的质量之比为1∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com