
I、某化学兴趣小组利用以下装置模拟合成氨并制备少量氨水
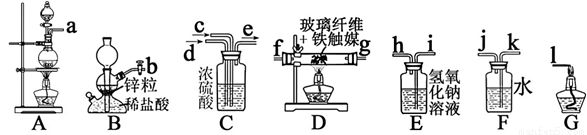
已知:加热(85℃)NH4Cl和NaNO2饱和溶液可以制取N2
B中仪器名称是___________________;
⑵为了完成实验,装置从左到右接口的连接顺序是_____ ______;
______;
⑶D中玻璃纤维的作用是_________________;
⑷小组中甲同学认为F装置不太合理,实验中会产生倒吸。乙同学认真分析后认为该装置无需改进,他的理由是________________________;
II、实验探究
⑸该小组同学利用制备的氨水再进行银镜反应实验。经查阅资料,配制的银氨溶液主要成分是[Ag(NH3)2]OH,小组同学对其组成进行了如下实验探究:
①在洁净的小试管中加入2mL 2%的AgNO3溶液,然后边振荡试管边滴加2%的稀氨水溶液,至最初产生的沉淀恰好溶解为止,制得银氨溶液。
②在制得的银氨溶液中加入无水乙醇,溶液变浑浊,过滤,用__________洗涤,得到白色固体;
③将该白色固体用适量蒸馏水溶解,得到无色溶液,用广范pH试纸检验溶液近似呈中性;向溶液中逐滴加入稀盐酸至不再产生沉淀,静置,取上层清液于另一支放有一小片铜的小试管中并微热,发现铜片的表面有气泡产生,遇到空气变成红棕色;另取少量上层清液加过量的NaOH溶液并加热,得到无色刺激性气体。由此确定通过上述方法制备的白色固体主要成分是___________________;
⑹请根据以上探究,设计实验来制备少量纯净的[Ag(NH3)2]OH溶液:取2mL 2%的AgNO3溶液于洁净的小试管中,_________________,即得到[Ag(NH3)2]OH溶液。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届黑龙江省哈尔滨市高三二模理科综合化学试卷(解析版) 题型:填空题
硫的多种化合物在工业中有重要应用。
(1)Na2S2可以做制革工业中原皮的脱毛剂,写出Na2S2的电子式______________。
(2)连二亚硫酸钠(Na2S2O4)又称保险粉,可作木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。
①Na2S2O4中S元素的化合价为_____________
②将甲酸(HCOOH)和NaOH溶液混合,再通入SO2气体,会得到保险粉,此时甲酸被氧化为CO2,该反应的化学方程式为_________________。
③Na2SO4暴露于空气中易吸收氧气和水蒸气而变质,发生反应时,当氧化剂和还原剂的物质的量之比为1:2时,反应的化学方程式为____________。
(3)铬会造成环境污染,某酸性废水中含有Cr2O72-,处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O72-转化为毒性较低的Cr3+,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中Cr3+浓度为0.52mg/L,达到排放标准。
①写出Na2SO5参加反应的离子方程式_______________________。
②处理后的废水中Cr3+的物质的量浓度为____________________。
(4)氢硫酸和亚硫酸是两种弱酸,回答下列问题
①0.1mol/L H2SO4与0.2mol/L H2S溶液等体积混合,所得溶液中S2-浓度为_____mol/L。(已知氢硫酸Ka1=1.0×10-8、Ka2=1.0×10-15,忽略H2S和H2O电离产生的H+)
②已知亚硫酸的Ka1=1.0×10-2、Ka2=6.0×10-13,设计实验证明亚硫酸第一步不完全电离。(可用实验用品:0.1mol/L亚硫酸、0.1mol/L NaHSO3溶液、0.1mol/L Na2SO3溶液,广泛pH试纸、pH计)
操作简述 | ______________ |
现象或数据 | ______________ |
结论 | H2SO3第一步不完全电离 |
查看答案和解析>>
科目:高中化学 来源:2017届贵州省贵阳市高三下学期第六次适应性考试理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A. 20℃时,AgCl固体在等物质的量浓度的NaCl、MgCl2溶液中的溶度积相同
B. 浓度为0.2mol/L的KHCO3溶液:c(H2CO3)>c(CO32-)
C. a mol/LHCN溶液与b mol/L NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b
D. 常温下,在0.1mol/L的NaOH溶液中,由水电离出的c(H+)<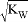
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列离子方程式中,正确的是
A. 铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑
B. 过氧化钠与反应:2O22-+2H2O=4OH-+O2↑
C. 碳酸氢钠与稀盐酸反应:CO32-+2H+=CO2↑+ H2O
D. 氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH-=Fe(OH)3↓
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.糖类、油脂和蛋白质都是高分子化合物
B.蛋白质的盐析和变性都是化学变化
C.石油的分镏和煤的干镏都是物理变化
D.乙醇和乙酸都能与金属钠发生反应
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三(实验班)第十次月考理综化学试卷(解析版) 题型:选择题
奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸常共存在一起,其结构简式如图所示。下列说法正确的是

A. 奎宁酸与莽草酸互为同分异构体
B. 两种酸含有的官能团完全相同
C. 两种酸均能发生加成反应、聚合反应和取代反应
D. 等物质的量的奎宁酸和莽草酸分别与足量Na反应,同温同压下产生H2的体积比为5:4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二3月月考化学试卷(解析版) 题型:填空题
软锰矿的主要成分为MnO2,含少量Al2O3和SiO2。闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下(中间产物的固体部分已经略去)。

已知: Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式______。
(2)步骤③中MnO2的其作用是______,另外一种物质X可以是______。
A.MgCO3 B.ZnO C.MnCO3 D.Cu(OH)2
(3)MnO2与Li构成LiMnO2,它可作为某锂离子电池的正极材料,电池反应方程式为: Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式______。MnO2可做超级电容器材料,用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是______.
(4)已知:H2S的电离常数K1=1.3×10―7,K2=7.0×10―15,在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L―1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS―浓度为1.0×10―4 mol·L―1时,Mn2+开始沉淀,则a=______。[已知:Ksp(MnS)=1.4×10―15]
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二3月月考化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A. 日常生活中常用95%的乙醇溶液来杀菌消毒,其实就是使蛋白质变性
B. 可用淀粉溶液来检测食盐中是否含碘
C. 误食重金属盐引起人体中毒,可喝牛奶或豆浆解毒
D. 人应该多吃蔬菜,因为蔬菜中纤维素在人体内可水解为葡萄糖,为人提供营养
查看答案和解析>>
科目:高中化学 来源:海南省、文昌中学2017届高三下学期联考化学试卷 题型:选择题
下列指定反应的离子方程式正确的是
A. 用惰性电极电解饱和MgCl2水溶液:2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B. 工业上将Cl2通入石灰乳中制漂白粉:Cl2+2OH-=Cl-+ClO-+H2O
C. 酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O
D. 碳酸氢钙与过量NaOH溶液反应:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+ CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com