
【题目】下列关于胶体和溶液的区别,叙述正确的是
A. 胶体带电荷,溶液不带电荷
B. 一束光线通过溶液时没有明显现象,而通过胶体时会出现明显的光路
C. 溶液中分散质可通过滤纸,胶体中分散质不能通过滤纸
D. 溶液长时间静置易产生浑浊,胶体长时间静置不产生浑浊
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
【题目】将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是( ) 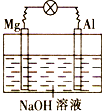
A.镁比铝活泼,镁失去电子被氧化成Mg2+
B.铝是电池负极,开始工作时溶液中会立即有白色沉淀生成
C.该装置的内、外电路中,均是电子的定向移动形成电流
D.该装置开始工作时,铝片表面的氧化膜可不必处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磺酰氯(SO2Cl2)和亚硫酰氯(SOCl2)均是实验室常见试剂.已知:
SO2Cl2(g)SO2(g)+Cl2(g) K1 △H=a kJ/mol (Ⅰ)
SO(g)+Cl(g)+SCl(g)2SOCl(g) K2 △H=b kJ/mol (Ⅱ)
(1)反应:SO2Cl2(g)+SCl(g)2SOCl2(g)的平衡常数K=(用K1、K2表示),该反应△H=kJ/mol(用a、b表示).
(2)为研究不同条件对反应(Ⅰ)的影响,以13.5g SO2Cl2充入2.0L的烧瓶中,在101kPa 375K时,10min达到平衡,平衡时SO2Cl2转化率为0.80,则0~10minCl2的平衡反应速率为 , 平衡时容器内压强为 kPa,该温度的平衡常数为;若要减小SO2Cl2转化率,除改变温度外,还可采取的措施是(列举一种).
(3)磺酰氯对眼和上呼吸道粘膜有强烈的刺激性,发生泄漏时,实验室可用足量NaOH固体吸收,发生反应的化学方程式为;亚硫酰氯溶于水的离子方程式为 .
(4)一定量的Cl2用稀NaOH溶液吸收,若恰好反应,则溶液中各离子浓度由大到小的顺序为;已知常温时次氯酸的Ka=2.5×10﹣8则该温度下NaClO水解反应的平衡常数Kb=molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乌头酸的结构简式如图所示,下列关于乌头酸的说法不正确的是( ) 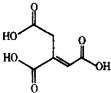
A.化学式为C6H6O6
B.乌头酸能使酸性高锰酸钾溶液或溴水褪色
C.乌头酸能发生水解反应和加成反应
D.含l mol乌头酸的溶液最多可消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同体积、相同pH的某一元强酸溶液①和某一元弱酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是( )
A.
B.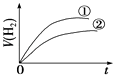
C.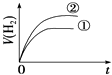
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某同学设计的制备少量氯气并进行系列实验的装置(夹持及加热仪器已略).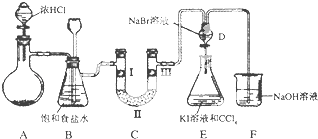
(1)若装置A中制备氯气选用的药品为固体二氧化锰和浓盐酸,请写出装置A中化学反应的离子方程式:;
(2)实验室也可用高锰酸钾制氯气:2KMnO4+16HCl(浓)═5Cl2↑+2MnCl2+2KCl+8H2O①请用双线桥标出该反应的电子转移方向和数目.
②该反应中的氧化剂是 , 若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量是 .
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ依次放入;(提示:硅胶是干燥剂,不与氯气反应)
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 碱石灰 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,D中发生反应的离子方程式为 , 若打开D装置的活塞,使D中溶液滴入E装置,振荡锥形瓶后静置一会儿,可以观察到的现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( ) 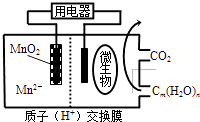
A.分子组成为Cm(H2O)n的物质一定是糖类
B.微生物所在电极区放电时发生还原反应
C.放电过程中,H+从正极区移向负极区
D.正极反应式为:MnO2+4H++2e﹣═Mn2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n
B.一种烃在足量的氧气中燃烧并通过浓H2SO4 , 减少的体积就是生成的水蒸气的体积
C.某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则y=4;若体积减少,则y>4;否则y<4
D.相同质量的烃,完全燃烧,消耗O2越多,烃中含H%越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题:
(1)钛有 ![]() Ti和
Ti和 ![]() Ti两种原子,其基态原子的电子排布式为;按电子排布Ti元素在元素周期表分区中属于区元素.
Ti两种原子,其基态原子的电子排布式为;按电子排布Ti元素在元素周期表分区中属于区元素.
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构如图1所示,它的化学式是 . 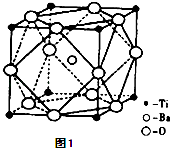
(3)氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金装饰的替代品.以TiCl4为原料,经过一系列反应,可以制得Ti3N4和纳米TiO2 . 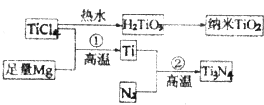
①TiCl4分子中4个氯原子不在同一平面上,则TiCl4的空间构型为 . ②纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如下: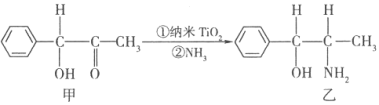
化合物甲的分子中采取sp2杂化的碳原子个数为 , 化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为 .
③另有一种氮化钛晶体的晶胞如图2所示,该氮化钛晶胞中含有个N原子,晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为 gcm﹣3(用NA表示阿伏加德罗常数的数值,只列算式).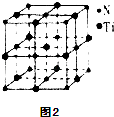
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com