
| A. | 2CH3CH2OH+${\;}_{\;}^{18}$O2$→_{□}^{Cu}$2CH3CH${\;}_{\;}^{18}$O+2H2O | |
| B. | CH3COOC2H5+H2${\;}_{\;}^{18}$O$→_{□}^{H+}$CH3COOH+CH3CH2${\;}_{\;}^{18}$OH | |
| C. | 2KMnO4+5H2${\;}_{\;}^{18}$O2+3H2SO4=K2SO4+2KMnSO4+5${\;}_{\;}^{18}$O2↑+8H2O | |
| D. | 2Na2${\;}_{\;}^{18}$O2+2H2O=4Na${\;}_{\;}^{18}$OH+O2↑ |
分析 根据物质中化学键的断键方式确定生成物,从而确定示踪原子的位置.
A.乙醇氧化断裂羟基上的氧氢键和与羟基相连的碳上的碳氢键;
B.乙酸与乙醇的酯化反应为可逆反应,反应中乙酸脱去羟基、乙醇脱去氢原子,所以水中的氧原子来自乙酸,若在平衡体系中进入加H2${\;}_{\;}^{18}$O,水中的18O会进入乙酸中;
C.根据化合价升降相等进行判断;
D.过氧化物与水反应实质为,过氧根离子结合水提供的氢离子生成过氧化氢,同时生成氢氧化钠,过氧化氢在碱性条件下不稳定,分解为水和氧气.
解答 解:A.乙醇氧化断裂羟基上的氧氢键和与羟基相连的碳上的碳氢键,18O存在于水中,醛中没有,故A错误;
B.乙酸与乙醇的酯化反应为可逆反应,反应中乙酸脱去羟基、乙醇脱去氢原子,所以水中的氧原子来自乙酸,若在平衡体系中进入加H2${\;}_{\;}^{18}$O,水中的18O会进入乙酸中,即含有18O的物质为乙酸和水,故B错误;
C.KMnO4中Mn元素化合价降低为2×(7-2)=10,H218O2中O元素化合价升高5×2×[0-(-1)]=10,化合价升降相等,高锰酸钾把过氧根氧化为氧气,18O全部在氧气中,故C正确;
D.过氧化物与水反应实质为,过氧根离子结合水提供的氢离子生成过氧化氢,同时生成氢氧化钠,过氧化氢在碱性条件下不稳定,分解为水和氧气,所以18O同时在水中和氧气中,不出现在氢氧化钠中,故D错误.
故选C.
点评 本题以化学反应机理探究为载体,考查有机物的反应、氧化还原反应等,难度中等,是对知识的综合能力的考查,D选项为易错点,容易认为氢氧化钠中的氧来自过氧化钠.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(SO2)/mol |
| 0 | 2.0 | 2.0 | 0 |
| 2 | 0.8 | ||
| 4 | 1.2 | ||
| 6 | 1.2 | 2.8 |
| A. | 0~2 min内的平均速率为υ (CO)=0.6 mol/(L•min) | |
| B. | 4 min后,平衡移动的原因可能是向容器中加入了2.0 mol的SO2 | |
| C. | 若升高温度,反应的平衡常数变为1.0,则正反应为放热反应 | |
| D. | 其他条件不变,若起始时容器中MgSO4、CO均为1.0 mol,则平衡时n(SO2)=0.6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
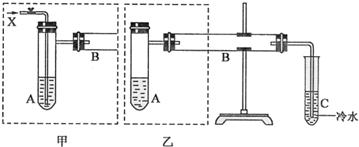
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M>N>P>Q | B. | M>P>Q>N | C. | N>Q>P>M | D. | P>M>N>Q |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| X | Y | ||
| Z | W | M |
 ;它的气态氢化物的结构式为H-S-H.
;它的气态氢化物的结构式为H-S-H.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然蛋白质水解的最终产物只有一种α氨基酸 | |
| B. | 甘油常应用于化妆品的生产,是因为其具有吸水性 | |
| C. | 淀粉、纤维素、油脂都是高分子化合物 | |
| D. | 苯酚和甲醛都有毒,故不能直接或间接用于制备消毒剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com