
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是__________。
②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为________、________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是_______________。
②E处干燥管中盛放的药品是碱石灰,其作用是_____________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量_____________(填“偏大”“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
【答案】检查装置气密性 除去装置中的水蒸气和二氧化碳 2NaHCO3![]() Na2CO3+H2O+CO2↑ Na2CO3·10H2O
Na2CO3+H2O+CO2↑ Na2CO3·10H2O![]() Na2CO3+10H2O↑ Na2CO3·10H2O和NaHCO3的质量分数测定结果偏小,NaCl的质量分数测定结果偏大 防止空气中的CO2和水蒸气进入D中影响测定结果 偏大
Na2CO3+10H2O↑ Na2CO3·10H2O和NaHCO3的质量分数测定结果偏小,NaCl的质量分数测定结果偏大 防止空气中的CO2和水蒸气进入D中影响测定结果 偏大 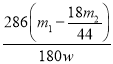 ×100%
×100%
【解析】
将混合物加热会产生H2O(g)、CO2等气体,应在C、D中分别吸收,先用浓硫酸吸收水,再用碱石灰吸收二氧化碳,即C中的干燥剂吸水后不能吸收CO2;由D的增重(NaHCO3分解产生的CO2的质量)可求出NaHCO3质量。由C的增重(Na2CO310H2O分解产生的H2O及已经知道的NaHCO3分解产生的H2O的质量)可求出Na2CO310H2O的质量,从而求出NaCl的质量。为排除空气中成分的干扰,应在实验前想法赶出装置中的空气,关键操作应是赶B中的空气,所以关闭K3,打开K1、K2就成为操作的关键,缓缓通入则是为了赶出效果更好;E中碱石灰可防止外界空气中的H2O(g)、CO2进入装置D影响实验效果,有气体参加的反应,在实验前要先检查装置的气密性,据此分析解答。
(1)①由实验原理可知,实验需要通过测量D装置内碱石灰的增重,计算生成的二氧化碳的质量,通过测量C装置的质量,计算生成的水的质量,故应首先检验装置的气密性;
③装置内有空气,含有水蒸气和二氧化碳,影响水蒸气和二氧化碳质量的测定,打开活塞K1、K2,关闭活塞K3,实验前要通入空气,赶走装置中含有水蒸气和二氧化碳,减少误差;
④含NaCl、Na2CO310H2O和NaHCO3的混合物加热时,NaHCO3分解生成Na2CO3、CO2和H2O,碳酸钠晶体失去结晶水生成Na2CO3,反应的化学方程式为:2NaHCO3![]() Na2CO3+H2O+CO2↑;Na2CO3·10H2O
Na2CO3+H2O+CO2↑;Na2CO3·10H2O![]() Na2CO3+10H2O↑;
Na2CO3+10H2O↑;
(2)①若加热反应后不鼓入空气,生成水蒸气质量和二氧化碳会滞留在装置中,使C、D装置增重减少,碳酸氢钠依据二氧化碳计算,而Na2CO310H2O的测定是根据生成水的总质量计算的,则Na2CO3·10H2O和NaHCO3的质量分数测定结果偏小,NaCl的质量分数测定结果偏大;
②干燥管中盛放的是碱石灰,碱石灰能吸收空气中的水蒸气和二氧化碳,所以干燥管的作用是防止空气中的CO2和水蒸气进入影响测定结果,若撤去E装置,则测定的碳酸氢钠的质量偏大;
③若样品质量为w g,反应后C、D装置增加的质量分别为m1 g、m2 g,D装置中增加的质量为二氧化碳的质量,碳酸氢钠分解生成的水蒸气的质量为x。根据反应方程式2NaHCO3![]() Na2CO3+H2O+CO2↑可知:产生44gCO2会同时产生18gH2O,反应产生CO2的质量是m2,则同时产生H2O的质量为
Na2CO3+H2O+CO2↑可知:产生44gCO2会同时产生18gH2O,反应产生CO2的质量是m2,则同时产生H2O的质量为![]() g;装置C吸收的是水蒸气,包括NaHCO3分解生成的和Na2CO3·10H2O分解生成的,Na2CO3·10H2O分解生成的水蒸气的质量=m1g-
g;装置C吸收的是水蒸气,包括NaHCO3分解生成的和Na2CO3·10H2O分解生成的,Na2CO3·10H2O分解生成的水蒸气的质量=m1g-![]() g,设Na2CO3·10H2O的质量为y,根据方程式Na2CO3·10H2O
g,设Na2CO3·10H2O的质量为y,根据方程式Na2CO3·10H2O![]() Na2CO3+10H2O↑中物质转化关系可知:286gNa2CO3·10H2O分解产生180gH2O,则产生H2O的质量为m1g-
Na2CO3+10H2O↑中物质转化关系可知:286gNa2CO3·10H2O分解产生180gH2O,则产生H2O的质量为m1g-![]() g,消耗的Na2CO3·10H2O的质量为y=
g,消耗的Na2CO3·10H2O的质量为y= g,所以混合物中Na2CO3·10H2O的质量分数为
g,所以混合物中Na2CO3·10H2O的质量分数为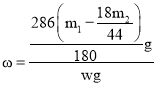 ×100%。
×100%。


科目:高中化学 来源: 题型:
【题目】从元素化合价和物质类别两个角度学习、研究物质的性质,是一种行之有效的方法。以下是氮元素形成物质的价类二维图的及氮的循环的部分信息。
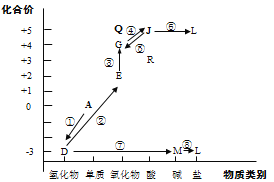
(1)①是一种人工固氮的重要途径,该反应的化学方程式是__________。
(2)②的化学方程式是__________。
(3)⑤的化学方程式是(任写一种)__________。
(4)R可与 NaOH溶液反应:HNO2+NaOH=NaNO2+H2O,该反应体现了R(HNO2)的_____性。
(5)Q的化学式是_______,Q属于酸性氧化物,写出Q与水反应的化学方程式________。
(6)L在水体中过多蓄积会导致水体富营养化。将水体调节为酸性后加入适量NaClO,可将L中阳离子转化为无污染气体以去除。写出L与NaClO反应的离子方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组采用如图所示装置,对浓硝酸与木炭的反应进行探究(已知:4HNO3![]() 4NO2↑+O2↑+2H2O)。
4NO2↑+O2↑+2H2O)。
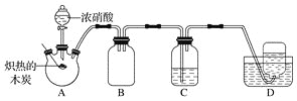
请回答下列问题:
(1)检查装置气密性后,将燃烧匙中的木炭在酒精灯上加热至炽热状态,伸入三颈烧瓶中,生成的气体的颜色为__,产生该气体的反应的化学方程式是__。
(2)装置C中盛有足量Ba(OH)2溶液,炽热的木炭与浓硝酸反应后可观察到C中出现白色沉淀,该白色沉淀为__(填化学式)。
(3)装置B的作用是__。
(4)装置D中收集到了无色气体,有同学认为是NO,还有同学认为是O2。
①下列对该气体的检验方法合适的是__(填字母)。
A.敞口观察装置D中集气瓶内气体的颜色变化
B.将湿润的蓝色石蕊试纸伸入集气瓶内,观察蓝色石蕊试纸是否变红
C.将带火星的木条伸入集气瓶中,观察木条是否复燃
②如果D中集气瓶内收集到的无色气体是氧气,则氧气的来源是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. NaCl(aq)![]() Cl2(g)
Cl2(g)![]() FeCl2(s)
FeCl2(s)
B. AlCl3(aq)![]() Al(OH)3(s)
Al(OH)3(s)![]() Al2O3(s)
Al2O3(s)
C. S(s)![]() SO3(g)
SO3(g)![]() H2SO4(aq)
H2SO4(aq)
D. N2(g)![]() NH3(g)
NH3(g)![]() NaHCO3(s)
NaHCO3(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氧化钠和过氧化钠的叙述正确的是( )
A. 氧化钠比过氧化钠稳定
B. 都能与二氧化碳、水反应产生氧气
C. 所含氧元素的化合价都为-2价
D. 阴阳离子的个数比都为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物是日常生活中的常用调味品。回答下列问题:
(1)五种元素中,原子半径最大的是________,非金属性最强的是________(填元素符号)。
(2)由A分别和B、D、E所形成的共价型化合物中,热稳定性最差的是__________(用化学式表示)。
(3)A、B、E形成的离子化合物电子式为____________,其中存在的化学键类型为____________。
(4)D最高价氧化物的水化物的化学式为________________。
(5)单质D在充足的单质E中燃烧,反应的化学方程式为__________________;D在不充足的E中燃烧,生成的主要产物的化学式为__________。
(6)单质E与水反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值。下列说法中正确的是( )
A.标准状况下,11.2L H2 与 11.2L D2 所含的质子数均为NA
B.1L0.1mol·L-1Fe2(SO4)3 溶液中含 Fe3+数目为 0.2 NA
C.3.2g 铜与 3.2g 硫隔绝空气加热使之充分反应,转移电子数为 0.1 NA
D.0.1mol 乙醇与 0.1mol 乙酸在一定条件下反应生成乙酸乙酯分子数为 0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是分离混合物时常用的仪器,可以进行的混合物分离操作分别是()
![]()
A.蒸馏、过滤、萃取、蒸发B.蒸馏、蒸发、萃取、过滤
C.萃取、过滤、蒸馏、蒸发D.过滤、蒸发、萃取、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)( )
选项 | 物质 | 选用的试剂 | 操作方法 |
A | NaCl(泥沙) | 水 | 过滤 |
B | CO2(CO) | O2 | 点燃 |
C | Fe(Zn) | 稀硫酸 | 结晶 |
D | CO2(HCl) | NaOH溶液 | 洗气 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com